Em primeiro lugar se você é uma mãe ou um pai de um feto ou bebê, como você queira chamar que já partiu, meus sentimentos. Aqui você encontrará um artigo que pode ajudar a descobrir o motivo da perda bem como identificar alguns fatores de risco e corrigi-los numa próxima gravidez se for o seu desejo. Eu lhe garanto como obstetra e como pai de Mateus, que se foi com 35 semanas de gestação que é possível ressignificar o luto. Estarei ao seu lado se você quiser que eu acompanhe sua próxima gravidez ou estarei torcendo para que dê tudo certo se você for uma seguidora das minhas redes socias ou leitora do meu site. Melhore seus hábitos, procure bnons profissionais, a tempestate vai passar e o (bebê) arco-íris vai chegar. Confiem em Deus, confie em você, busque ajuda e siga em frente, enfrente!!!
Se você é profissional de saúde, especialmente obstetra ou enfermeira(o) obstetra o artigo abaixo e bem interessante e completo.
Se você é tentante ou gestante sem histórico de óbito fetal, não recomendo a leitura, texto bem pesado para o seu momento.
Glaucius Nascimento 20/01/2021
ARTIGO – ÓBITO FETAL INTRAUTERINO
Mark M. Maslovich ; Lori M. Burke .Informação sobre o autor
Última atualização: 8 de novembro de 2020 .
Introdução
O Centro de Estatísticas de Saúde dos Estados Unidos define morte fetal como o parto de um feto sem sinais de vida, conforme indicado pela ausência de respiração, batimentos cardíacos, pulsação do cordão umbilical ou movimentos definidos dos músculos voluntários, independentemente da duração da gravidez . Natimorto é uma morte fetal após uma idade gestacional definida e / ou peso fetal, ambos historicamente sem uniformidade. Atualmente, a definição mais reconhecida de natimorto é a morte fetal que ocorre com 20 semanas de gestação ou maior ou com peso ao nascer maior ou igual a 350 gramas. A padronização da definição de natimorto é uma prioridade atual. [1]Nos Estados Unidos, a interrupção da gravidez por anomalias fetais e a indução do parto para ruptura prematura pré-viável de membranas são relatadas como interrupções da gravidez e não como natimortos. “Natimorto” substituiu “morte fetal intrauterina” como a terminologia de escolha com base nas opiniões de grupos de pais. Uma tentativa está em andamento para usar natimorto em todas as publicações científicas. Para esta publicação, morte fetal intrauterina e natimorto são considerados sinônimos.
A comparação das taxas de natimortos entre e dentro dos países é limitada devido à não uniformidade da definição de natimortos e à coleta incompleta de dados de natimortos. Globalmente, menos de 5 por cento dos natimortos são registrados. [2] A morte fetal intrauterina é a quinta causa de morte em todo o mundo. Atualmente, há uma compreensão limitada da fisiopatologia responsável pela morte fetal. Globalmente, natimorto inexplicável é relatado em 76% dos casos. [2] [3]The Lancet publicou “The Ending Preventable Stillbirths Series Study Group”, que ajudou a promover os esforços globais de saúde pública. O objetivo inicial era reduzir a taxa de natimortos para menos de 15/1000. Isso já foi alcançado em muitos países industrializados; no entanto, os países da Ásia e da África ainda têm taxas de natimortos muito mais altas atribuídas principalmente à falta de acesso a serviços de saúde. Estima-se que 98% dos natimortos globais ocorrem em países de baixa e média renda. [4]
A natimortalidade tem muitas causas: complicações intraparto, hipertensão, diabetes, infecção, anomalias congênitas e genéticas, disfunção placentária e gravidez continuada além de quarenta semanas. Este é um evento catastrófico com consequências duradouras para toda a sociedade. Precisamos aprender mais sobre por que ocorrem natimortos. Esse conhecimento pode ajudar as pessoas afetadas a lidar com o luto e, mais importante, a se preparar para reduzir o risco de natimortos em gestações subsequentes. Esta atividade analisa o papel da equipe de saúde na avaliação, gerenciamento e melhoria do atendimento a pacientes com diagnóstico de natimorto.
Etiologia
Os dados globais sobre as causas de natimortos são limitados devido à dificuldade em atribuir a causa. [5] A natimortalidade inexplicada é a causa mais comumente relatada, relatada em 76% dos casos em todo o mundo. [6] Metade dos natimortos do mundo estão ligados a complicações intraparto; a maioria dessas mortes provavelmente poderia ser evitada com maior acesso a cuidados de saúde qualificados. [2]
O estudo Stillbirth Collaborative Research Network descobriu que os fatores de risco de natimortos conhecidos no início da gravidez eram responsáveis por apenas uma pequena fração do risco de natimortos. Apenas natimorto anterior ou perda de gravidez por nascimento prematuro ou restrição de crescimento fetal demonstraram valor preditivo. [7] O risco de natimorto é maior em mulheres com um natimorto inexplicável anterior. Um estudo descobriu que o risco é cinco vezes maior e outro duas vezes maior. [8] [9] O nascimento prematuro anterior, com menos de 34 semanas, aumenta o risco de um natimorto subsequente três vezes. A história adicional de parto de um feto com crescimento restrito aumenta o risco de natimortos subsequentes seis vezes. [10] Em comparação com uma mulher com um natimorto anterior, o risco de natimorto é ainda maior para mulheres que deram à luz um feto viável e com crescimento restrito antes de 32 semanas de idade gestacional. [9] [11]
O Instituto Nacional de Desenvolvimento da Saúde Infantil (NICHD) Eunice Kennedy Shriver criou a Rede de Pesquisa Colaborativa de Natimortos. Ele avaliou a causa de natimortos em 20 semanas ou mais entre 2006 e 2008 em 59 hospitais em cinco estados dos EUA. As principais causas de natimortalidade nos EUA foram : descolamento prematuro da placenta e complicações obstétricas das gestações gemelares e ruptura prematura pré-termo das membranas amnióticas. Este estudo mostrou que a causa da natimortalidade pode ser atribuída em 75% dos casos quando uma avaliação sistemática é realizada, conforme será descrito a seguir.
Anormalidades da placenta:
Restrição de crescimento fetal e anormalidades placentárias são os achados mais prevalentes em natimortos. A maioria das gestações com esses achados, entretanto, não resulta em natimorto. [12]Anormalidades placentárias também podem ser encontradas em natimortos sem evidência de crescimento prejudicado. A altura da sínfise-fundo, usada para estimar o crescimento fetal em série nas consultas de pré-natal, tem baixa sensibilidade e especificidade para detectar bebês pequenos para a idade gestacional. Nesse momento, apenas o volume placentário, a inserção velamentosa e a presença de uma única artéria umbilical podem ser detectados no pré-natal. Diagnosticar a restrição do crescimento fetal no útero é difícil. Novos métodos são necessários para avaliar a estrutura e a função da placenta de forma não invasiva. Se o peso ao nascer for menor que o percentil 10, o risco de restrição de crescimento é de 30%, e se o peso ao nascer for menor que o percentil 3, o risco é de 70%. [13] O risco de natimorto é relativo ao grau de restrição de crescimento, com o maior risco de natimorto para aqueles que dão à luz fetos com crescimento mais restrito. [10] O risco de natimortalidade é de 15/1000 para pesos ao nascer menores que o percentil 2,5 e 25/1000 para pesos ao nascer menores que o percentil 5. [14] [15]
Fatores placentários, como descolamento prematuro da placenta, são encontrados em 6% dos natimortos. [13] Uma história de descolamento prematuro da placenta aumenta o risco de natimorto. Esse risco é maior para fetos prematuros. O uso de cocaína, fumo, hipertensão e pré-eclâmpsia aumentam o risco de descolamento prematuro da placenta e natimorto. Além disso, condições incomuns da placenta, incluindo coriocarcinoma ou corioangioma, aumentam o risco de natimorto. [16] [17]
Diabetes
O diabetes aumenta o risco de natimortos em até cinco vezes. [12] [18] [19] Uma meta-análise mostrou que apenas melhorar o controle da glicose antes da concepção reduz a taxa de natimortos. [20] Com o controle glicêmico ideal, o risco de natimorto pode ser reduzido. [21]Em diabéticos tipo 1, a taxa de natimortos é de 16,1 por 1000 nascimentos. O controle deficiente do diabetes determinado por níveis elevados de hemoglobinas glicosiladas antes da gravidez (OR 1,03) e posteriormente na gravidez (OR 1,06) foram associados a natimortos. Em diabéticos tipo 2, a taxa de natimortos é de 22,9 / 1000 nascimentos. Um IMC mais alto (OR 1,07) e hemoglobina glicosilada elevada antes da gravidez (OR 1,02) foram associados a natimortos. O peso ao nascer pode ser afetado pelo diabetes e também está relacionado ao risco de natimorto. Se o peso ao nascer for inferior ao 10º percentil, o risco de natimortos é elevado seis vezes em mães com diabetes tipo 1 e três vezes naquelas com diabetes tipo 2 em comparação com fetos pesando entre 10 e 90 percentis. Com diabetes tipo 2, o risco de natimorto era duas vezes maior se o peso ao nascer estivesse acima do percentil 95. Um número significativamente maior de natimortos em mulheres com diabetes tipo 2 é do sexo masculino. Um terço dos natimortos associados ao diabetes ocorrem a termo. A taxa mais alta de natimortos ocorre na 38ª semana para o diabetes tipo 1 e na 39ª semana para o diabetes tipo 2.[22]
Raça
Mulheres negras não hispânicas nos Estados Unidos têm uma taxa maior de natimortos (11 por 1000 nascimentos) em comparação com outros grupos raciais. Este grupo também tem uma incidência maior de diabetes, hipertensão, ruptura prematura da membrana e descolamento podem ser responsáveis pela maior taxa de natimortos. [18]
Obesidade
A obesidade é um fator de risco independente para natimortos, mesmo após o controle de diabetes, tabagismo, diabetes gestacional e pré-eclâmpsia. A obesidade é um grande problema de saúde nos países desenvolvidos e é definida como um índice de massa corporal superior a 30 kg / m2. Mulheres não obesas têm um risco de natimortos de 5,5 por 1000. O risco é de 8 por 1000 para IMC de 30 a 39,9 kg / m ^ 2 e 11/1000 para IMC maior que 40 kg / m ^ 2. [23] [24] [25] [26] Mulheres com sobrepeso com IMC de 25 a 29,9 kg / m ^ 2 têm um OR 1,37 (IC de 95%: 1,02-1,85) e mulheres obesas classe IV com IMC maior que 50 kg / m ^ 2 tem um OR 5,04 (IC 95%: 1,79-14,07). [27]
Idade
O risco de natimorto aumenta com a idade materna avançada devido ao aumento do risco de aneuploidia e complicações médicas da gravidez. Mesmo após o controle desses fatores de risco, a idade materna acima de 35 anos tem um risco aumentado de natimorto, que é acentuado pela nuliparidade. Aos 40 anos, o risco é de 1/116 para nulíparas e 1/304 para multíparas. [28] [29] A natimortalidade pode ser causada por anormalidades cromossômicas letais, que são mais prevalentes quando a idade materna é maior que 35. [30] Treze por cento dos natimortos têm um cariótipo anormal. [17] Esses cariótipos anormais incluem síndrome de Turner (XO em 23%), síndrome de Down (trissomia 21 em 23%), síndrome de Edwards (trissomia 18 em 21%) e síndrome de Patau (trissomia 13 em 8%). [31]Uma idade paterna acima de 40 também aumenta o risco de natimorto. [32]
Uso indevido de substância
Fumar tabaco aumenta o risco de natimortos, tanto antes como durante o parto (15/1000). Parar de fumar no início do segundo trimestre reduz o risco de um não fumante. [33] Comparado a nunca fumar, o fumo ativo está associado a uma razão de chances de 1,44 (IC 95%: 1,20-1,73) para ter um ou mais natimortos. Em comparação com nunca fumantes, as mulheres expostas ao fumo passivo por mais de dez anos na infância ou 20 anos na idade adulta em casa ou dez anos no trabalho adulto têm uma razão de chance de 1,55 (IC 95%: 1,21-1,97) para ter um ou mais natimortos. [34]
A causa direta de natimortos associada ao consumo de álcool não foi identificada, mas o risco está bem documentado. Na gravidez, 11,5% das gestantes consomem pelo menos uma bebida em 30 dias e 3,9% consomem quatro ou mais bebidas em pelo menos uma ocasião durante um período de 30 dias. A razão de chances para natimortalidade associada ao uso de álcool é de 1,36 (IC 95%: 1,05-1,76). [35]
Na gravidez, 4,4% das mulheres usam drogas ilícitas. Há uma OR de 1,5 para natimortos associada ao uso de opioides na gravidez (IC 95%: 1,3-1,8) e uma OR de 5,1 para natimortos associada ao uso de metanfetaminas na gravidez (IC 95%: 3,7-7,2). [36]
O achado mais comum na gravidez complicado pelo uso de substâncias é a restrição de crescimento. Disfunção placentária, vasoconstrição, hipóxia e alteração nos produtos químicos endógenos responsáveis por regular o bem-estar ideal são atribuídos ao aumento do risco de natimorto associado ao uso indevido de substâncias. [36]
Idade Gestacional> 38 semanas
O risco de natimortos aumenta com a idade gestacional precoce e tardia. A indução do parto após 40 semanas pode diminuir o risco de natimorto e parto cesáreo [145]. O risco de natimorto com 37 semanas é de 0,21 / 1000. Na 38ª semana, o risco de natimortalidade em gestações com partos espontâneos é equivalente àquelas com parto induzido. Às 42 semanas, o risco de natimorto é de 1,08 / 1000. Ao considerar o benefício de induzir o parto para reduzir a natimortalidade, outros fatores, incluindo resultados adversos neonatais e maternos, devem ser considerados. Com 41 semanas, mais de 1400 partos teriam que ser induzidos para prevenir um natimorto. A indução do parto é recomendada após 42 semanas e pode ser considerada após 41 semanas de gestação.
Hipertensão
A hipertensão crônica aumenta três vezes o risco de natimortos. [12] A hipertensão é uma condição comum que complica a gravidez; a incidência é de 9,6% (IC 95%: 6,9-12,1). [37] Os objetivos e resultados para o tratamento da hipertensão crônica na gravidez são mal compreendidos no momento. [38] A hipertensão gestacional mostra um risco aumentado de natimorto em alguns estudos, mas não em outros. [13]
Defeitos Congênitos
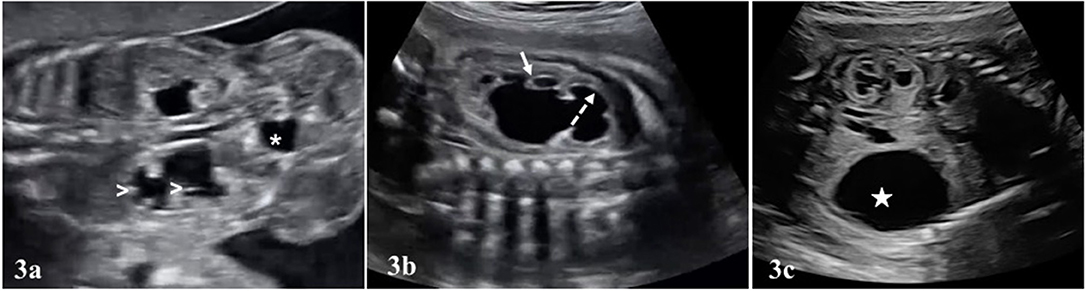
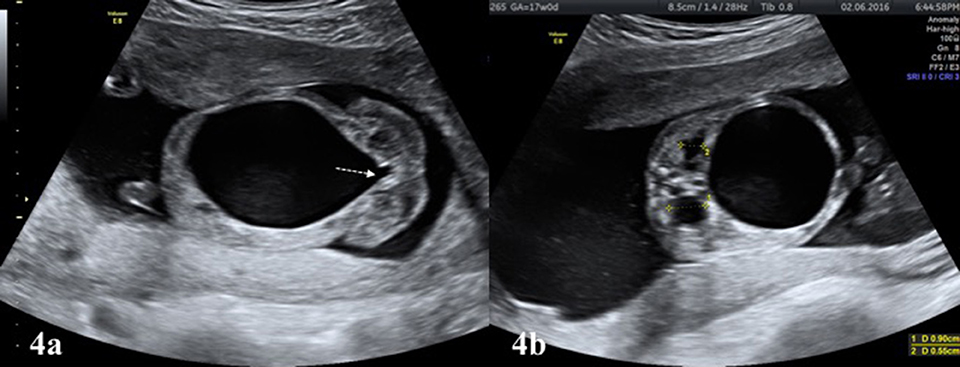
Defeitos congênitos, definidos como anormalidades físicas ou bioquímicas, ocorrem em 1/33 da gravidez e estão associados a um risco maior de natimorto. A detecção de defeitos congênitos no pré-natal pode impactar a política de vigilância pré-natal na esperança de reduzir o risco de natimortalidade. O risco de natimortos é 11/1000 para extrofia da bexiga e 490/1000 para o complexo membro-parede-abdominal (Limb body wall complex); mesmo para defeitos congênitos isolados que não afetam órgãos importantes, o risco de natimortos aumenta. O risco de natimorto associado à fenda labial com fenda palatina é 10/1000, deficiências transversais dos membros 26/1000, deficiências longitudinais dos membros 11/1000 e defeitos associados à banda amniótica nos membros 110/1000. O risco aumentado de natimortos para agenesia sacral é 13/1000, espinha bífida isolada 24/1000,[39] Características dismórficas ou problemas esqueléticos são encontrados em 20% dos natimortos e até 20% têm malformações graves. [17] [40]
Polidrâmnio
A polidrâmnio complica 1% a 2% das gestações. É definido como um índice de líquido amniótico maior que 24 cm ou uma bolsa vertical mais profunda de líquido maior ou igual a 8 cm, conforme avaliado por ultrassom abdominal. Cinquenta por cento das vezes, a causa da poliidrâmnio é idiopática. Nesses casos, há associação com risco aumentado de macrossomia fetal, bem como risco relativo de natimorto duas a cinco vezes maior. [41]A polidrâmnio está associada a um maior risco de parto prematuro, má apresentação e prolapso do cordão, o que pode explicar por que está associada a um risco aumentado de natimorto. Há também um risco de 3,2% de aneuploidia em gestações complicadas por polidrâmnios idiopáticos, que é significativamente maior do que na população em geral e pode contribuir para um aumento no risco de natimortos. [42] A polidrâmnio também está associada a anomalias congênitas do sistema nervoso central, sistema gastrointestinal, sistema cardíaco, hidropisia e aneuploidia, bem como condições maternas, como diabetes, infecção e diabetes insípido associadas ao uso de lítio. Um estudo realizado na Etiópia mostrou um risco 13,4 vezes maior de natimortos em gestações complicadas por polidrâmnio. [43]É incerto se a condição fetal ou materna que causa poliidrâmnio leva a um risco maior de natimorto. O risco de resultados adversos na gravidez aumenta com o grau de polidrâmnio em mulheres com fatores de risco identificados para polidrâmnio, mas não em casos idiopáticos. [44] Esse risco é atribuído às comorbidades associadas a casos não idiopáticos, exceto diabetes. [45]
O risco relativo de natimortalidade é de 7,7 para polidrâmnio persistente em comparação com gestações com polidrâmnio resolvido. Em comparação com gravidezes não afetadas por polidrâmnio, o risco de natimortalidade para mulheres com polidrâmnio aumenta com a idade gestacional, com o risco mais baixo em 26 semanas de gestação, sete vezes maior risco relativo em 37 semanas e 11 vezes maior risco relativo em 40 semanas. O risco persiste mesmo após a exclusão de variáveis de confusão e aumenta acentuadamente no prazo. [46] [44]
Oligoidrâmnio
Oligoidrâmnio é definido como um índice de líquido amniótico (ILA) menor ou igual a 5 cm, ou uma bolsa vertical máxima de menos de 2 cm. A bolsa vertical mais profunda é a medida preferida, uma vez que o AFI detecta mais casos de suspeita de oligoidrâmnio e polidrâmnio, o que resulta em mais induções de parto sem melhora no resultado perinatal. [37]
O oligoidrâmnio está associado a um risco aumentado de fetos pequenos para a idade gestacional e natimortos. Para natimortos, o risco é de 11,54 (IC 95%: 4,05-32,9). [47] O parto para oligoidrâmnio pode ser indicado na 36-37 semanas de gestação, quando nenhuma outra comorbidade for identificada ou antes, para monitoramento fetal não estimulante. A termo, quando não associada a nenhum outro fator de risco, as gestações com oligoidrâmnio idiopático apresentam resultados semelhantes às gestações com volume normal de líquido amniótico. [45] [46] Sugere-se que o oligoidrâmnio isolado pode ser seguido com teste pré-natal e parto planejado após 39 semanas, a menos que indicado por outros motivos. [48] [49] [37]
Cordão umbilical
O cordão umbilical pode estar implicado em natimortos; no entanto, uma corda nucal pode estar presente em até 30% dos partos normais. A avaliação da evidência de obstrução do cordão ou comprometimento circulatório é necessária ao avaliar a causa do natimorto.
Cuidado pré-natal de início tardio
O atendimento pré-natal tardio e o parto domiciliar anterior são fatores de risco independentes para resultados perinatais adversos subsequentes. [50]
Múltiplas Gestações
Gestações gemelares aumentam a taxa de natimortos em quatro vezes (19,6 / 1000), e para trigêmeos ou quadrigêmeos, a taxa é ainda maior em 30/1000. [51] Restrição de crescimento, nascimento prematuro, anomalias fetais, idade materna avançada e síndrome de transfusão de gêmeos podem ser fatores contribuintes. Gêmeos monocoriônicos têm um risco maior de natimortos devido ao risco de emaranhamento do cordão umbilical. [52]
A imunização Rh, hipertensão gestacional e diabetes gestacional apresentaram maior chance de natimorto, mas não alcançaram significância estatística . [13]
Infecção
A infecção como causa de natimorto pode ser sub-representada porque os sinais e sintomas de infecção muitas vezes não são detectados e a avaliação de infecção geralmente não é realizada. [53] A natimortalidade relacionada à infecção varia de 5% a 22%. [6] Em países desenvolvidos, a infecção é responsável por 19% dos natimortos antes de 28 semanas, mas apenas 2% dos natimortos a termo. [54] Quando uma infecção é a causa da natimortalidade, o parto prematuro espontâneo é comum. Um estudo de coorte nos Estados Unidos demonstrou a infecção como causa provável ou possível de natimorto em 12,9% dos casos. [53] As bactérias predominantes cultivadas incluíram Escherichia coli 29%, estreptococos do grupo B (GBS) 12%, enterococos 12% e raramente Listeria monocytogenes. A avaliação placentária encontrou evidências de infecção em 99% dos casos de cultura positiva. Organismos não bacterianos que causam natimortos incluem citomegalovírus 8%, parvovírus 3%, sífilis 2% e vírus herpes simplex 2%. É improvável que a infecção seja a causa de natimortos, a menos que resulte em autópsia significativa ou achados placentários. A triagem sorológica para toxoplasmose, clamídia, rubéola ou herpes geralmente não é indicada quando essas infecções não são detectadas no exame placentário ou de autópsia. [53] A malária deve ser rastreada em áreas endêmicas. O vírus da imunodeficiência humana aumenta o risco de natimorto.
A infecção por estreptococos do grupo B está ligada à causa de natimortos em 1% dos natimortos nos países desenvolvidos e 4% nos países africanos. Essas estimativas são ruins devido à baixa qualidade dos dados coletados. Em Moçambique, a taxa de natimortos associados a estreptococos do grupo B foi de 17%, o que pode ser devido à elevada taxa de rastreio aí realizado. [55] O GBS deve ser isolado de um local estéril do corpo, como o líquido cefalorraquidiano e a detecção isolada de uma superfície, ou o esfregaço da placenta não se qualificaria como um caso relacionado ao GBS
Ter uma infecção por clamídia tratada antes ou durante a gravidez não aumenta o risco de parto prematuro, restrição de crescimento intrauterino ou natimorto. [56]
Síndrome Antifosfolipídica
A síndrome antifosfolipídica (SAF), além de eventos trombóticos, foi associada à natimortalidade desde 1984. [57] [58] Para diagnosticar a síndrome antifosfolipídica, um critério clínico mais um critério laboratorial devem ser atendidos. Os anticorpos anticardiolipina, anticorpo anti-beta2 glicoproteína 1, ou o anticoagulante lúpico, devem estar acima do percentil 99 e estar presentes em duas ocasiões com pelo menos 12 semanas de intervalo. Em alguns casos, esses anticorpos podem não ser detectados devido à limitação dos ensaios atuais. [59] Esses anticorpos podem ser encontrados em 5% das pessoas sem sintomas clínicos. [60] O risco de natimortalidade é maior quando todos os três critérios laboratoriais são positivos e menor quando o anticoagulante lúpico é negativo. [61] [62]Recentemente, o anticorpo anti-beta2 glicoproteína 1 domínio-1 foi associado à morbidade no final da gravidez. [63] A positividade do anticoagulante lúpico no início do estudo foi associada a uma razão de chances de 8,3 (IC 95%: 3,6-19,3) para desfechos adversos na gravidez. [64]
Um risco aumentado de morbidade na gravidez em mulheres com SAF é observado em mulheres com história de lúpus eritematoso sistêmico, tromboses, resultados adversos anteriores da gravidez e baixos níveis de complemento no primeiro trimestre. [65] [62] [66] [62] [65] [67] Pacientes com lúpus eritematoso sistêmico têm um risco de 15% a 25% de natimorto e precisam ser rastreados para anticorpos antifosfolipídios no pré-natal e tratamento oferecido para reduzir os resultados adversos da gravidez .
Os critérios clínicos para o diagnóstico de APS incluem uma história confirmada de um evento trombótico sem evidência de inflamação na parede do vaso, uma ou mais mortes fetais inexplicáveis após 10 semanas de idade gestacional, três ou mais mortes antes da 10ª semana de gestação, ou um prematuro parto devido a eclâmpsia, pré-eclâmpsia com características graves ou outras insuficiências placentárias.
Atualmente, o tratamento disponível para SAF permanece associado a uma gravidez malsucedida de 20% a 30% das vezes. [68] Essa síndrome está associada à restrição de crescimento, pré-eclâmpsia e nascimento prematuro. [69] O mecanismo de ação exato que leva à natimortalidade não é conhecido. O mecanismo de SAF obstétrico parece ser diferente do APS trombótico não obstétrico. [70]O tratamento neste momento é com heparina e aspirina. Os agentes mais novos em estudo incluem a pravastatina, que pode melhorar os resultados em mulheres com pré-eclâmpsia precoce atribuída à síndrome. A hidroxicloroquina pode modular o sistema imunológico e ajudar a reduzir os sintomas da gravidez em mulheres com SAF. SAF Catastrófica é a perda de função de órgãos vitais graves atribuídos a essa síndrome, e a mortalidade chega a 30%, apesar do tratamento. [71] Essa variante de SAF afeta menos de 1% dos pacientes com SAF. Embora raro, seu resultado potencialmente letal exige a importância de seu reconhecimento.
A anticoagulação vitalícia é recomendada para qualquer pessoa com síndrome antifosfolipídica e um evento trombótico prévio. Com o diagnóstico de gravidez, a varfarina deve ser interrompida e iniciada heparina de baixo peso molecular. Ao contrário da varfarina, que atravessa a placenta e aumenta o risco de teratogenicidade fetal e hemorragia, a HBPM não atravessa a placenta e é segura para o feto. [72]
Uma história pessoal ou familiar de tromboembolismo parece ter um risco aumentado de natimorto. [73]
Colestase intra-hepática
A colestase intra-hepática pode afetar 0,1% a 2% das mulheres grávidas. [74] [75] Casos de arritmias fetais foram documentados em gestações complicadas por colestase. [76] A maioria desses natimortos tem sinais de anóxia aguda, mas nenhum sinal de restrição de crescimento ou comprometimento uteroplacentário de longo prazo. [77] Uma meta-análise recente de estudos observacionais sugeriu que não houve diferença geral nos natimortos atribuíveis à colestase obstétrica (CO). Neste estudo, um risco maior de natimortos foi observado apenas no subgrupo com CO grave definido por ácidos biliares igual ou superior a 100 micromoles / litro. A indução médica após 37 semanas, neste grupo, ainda é aconselhada. [78]A maioria das mulheres com CO terá ácidos biliares abaixo de 100 micromoles / L e podem ter certeza de que o risco de natimortos não é elevado. [79] A concentração de ácidos biliares pode mudar rapidamente no final da gravidez e, portanto, deve ser medida semanalmente. [80] Embora os ácidos biliares possam estar elevados após a alimentação em comparação com o jejum, os níveis médios são semelhantes e, portanto, os testes podem ser realizados em jejum ou pós-prandial. [79] Se o tratamento de CO com ácido ursodeoxicólico reduz o risco de natimortos, justifica um estudo futuro.
Epidemiologia
A cada ano, mais de 2,6 milhões de gestações resultam em natimortos no terceiro trimestre em todo o mundo, ou seja, 18,4 / 1000 nascimentos totais. [2] Apesar da melhora na mortalidade neonatal e infantil nas últimas décadas, a taxa de natimortos diminuiu mais lentamente. Nos EUA, para mortes ocorridas entre 22 semanas de gestação e um ano de vida, 25,2% são mortes fetais de 22 a 27 semanas de gestação, 24,5% são mortes fetais de 28 semanas de gestação até o nascimento, 33,8% são mortes neonatais com menos de 28 dias , e 16,1% ocorrem de 28 dias a 1 ano de idade. [81]
A taxa de natimortos ultrapassou a taxa de mortalidade infantil nos EUA em 2013. [82] Nos EUA, cerca de 1/168 gestações resultaram em natimortos ou 23.595 por ano, de acordo com dados de 2015. [83] A taxa de natimortos nos EUA manteve-se inalterada desde 2006, 5,96 / 1000 nascimentos totais. [81] Isso excede o de outros países industrializados como a Suécia (3/1000 nascimentos totais) e França (3,87 / 1000 nascimentos totais). [83] Em países de alta renda, as taxas de natimortos variam de 1,3 a 8,8 / 1000 nascimentos totais. A taxa de natimortos no Paquistão e na Nigéria é de 40/1000.
Fisiopatologia
A sobrevivência de um feto no útero depende de vários fatores. Esses fatores podem ser divididos em bem-estar do hospedeiro em seu ambiente, a função da unidade útero-placentária, a condição do ambiente em que vive o feto e a ausência de fatores fetais letais. Um único insulto ou uma combinação de fatores pode afetar a função desses fatores de sustentação da vida e levar a um natimorto. A capacidade de manter e apoiar uma gravidez depende de várias adaptações fisiológicas, hormonais e anatômicas. [84]
A integridade da unidade uteroplacentária pode ser comprometida por estrutura, função ou anomalias genéticas ou insultos como hemorragia ou infecção. Os achados placentários podem incluir 1) inserção do cordão umbilical único, 2) inserção do cordão umbilical velamentoso, 3) inserção do cordão umbilical furcado, 4) inserção circunmarginata das membranas placentárias, 5) inserção circunvalada das membranas placentárias, 6) imaturidade vilosa terminal, 7 ) hipoplasia vilosa terminal, 8) hiperplasia vilosa terminal, 9) corioamnionite aguda das membranas placentárias, 10) corioamnionite aguda da placa coriônica, 11) funisite aguda, 12) arterite aguda do cordão umbilical, 13) flebite aguda do cordão umbilical, 14) coriônica vasculite aguda da placa dos vasos sanguíneos fetais, 15) alterações degenerativas vasculares da placa coriônica, 16) vilite aguda, 17) vilite crônica,[84]
Em um estudo de patologia placentária e natimorto, dos 25 achados examinados, 15 foram significativamente associados com natimorto e 11 com restrição de crescimento. As anomalias da placenta foram associadas a natimortos em fetos com e sem evidência de anomalia de crescimento. Os achados placentários de 10/11 associados à restrição de crescimento também foram associados a um risco aumentado de natimorto. Cinco achados placentários, no entanto, foram associados a natimortos, mas não com restrição de crescimento. Neste estudo, observando a patologia placentária, cinco padrões foram destacados. [84]
No grupo 1, natimorto ocorreu na ausência de restrição de crescimento. O efeito foi agudo e severo. Os achados incluíram corioamnionite, alterações degenerativas vasculares da placa coriônica fetal, depósitos fibrinóides perivilosos e intervilosos, trombos vasculares fetais na placa coriônica.
O Grupo 2 demonstrou restrição de crescimento associada apenas a natimortos. Isso incluiu a inserção do cordão velamentoso, hiperplasia vilosa terminal e infartos do parênquima. Com essas condições, pode prejudicar a função placentária e levar à restrição do crescimento e à natimortalidade. Em suas formas mais brandas, pode não afetar o crescimento e resultar em nascimento.
O Grupo 3 apresentou restrição de crescimento apenas em nascidos vivos. Os resultados incluíram uma única artéria umbilical, que pode prejudicar a circulação cronicamente e levar à restrição do crescimento sem causar natimorto. Hipoplasia vilosa terminal e infarto do parênquima tiveram efeitos diferentes dependendo se o feto era prematuro ou a termo. Pré-termo, eles foram associados com restrição de crescimento e natimorto, e a termo, eles foram associados com restrição de crescimento e nascidos vivos. Isso sugere que a maior gravidade pode resultar em natimorto antes do termo, e uma condição menos grave pode resultar em restrição de crescimento e nascimento vivo.
O grupo 4 teve restrição de crescimento semelhante em nascidos vivos e natimortos. O peso da placenta em nascimentos prematuros e a formação de trombos intraparenquimatosos em nascidos a termo foram ambos associados à restrição de crescimento em natimortos e vivos. Nesses casos, um segundo insulto pode ter explicado o natimorto.
O Grupo 5 teve diferentes padrões de restrição de crescimento para nascidos vivos e natimortos. Houve um efeito mais severo na função placentária; o grupo com restrição de crescimento e natimorto e efeito mais brando na função placentária resultou no grupo com restrição de crescimento e nascido vivo. A natimortalidade pré-termo demonstrou imaturidade vilosa terminal, vilosidades avasculares, edema placentário ou hematoma retroplacentário. Natimorto a termo demonstrou hematoma retroplacental. Todas as anormalidades placentárias associadas à restrição de crescimento também foram associadas a natimortos, exceto para hipoplasia vilosa terminal. [84]
História e Exame Físico
A história e os dados obtidos durante o cuidado pré-natal de rotina e o cuidado perinatal ajudarão a estabelecer uma causa de natimortalidade na maioria dos casos, independentemente da disponibilidade de autópsia. [85] A história deve incluir detalhes sobre dor abdominal, sangramento ou secreção vaginal, pressão pélvica e a última vez que um movimento fetal foi observado.
História
A história materna inclui idade, gravidade, paridade, qualquer história de hipertensão, diabetes, hipercoagulabilidade, doença autoimune ou câncer: exposição à infecção (Zika, parvovírus, CMV, toxoplasmose, sífilis, malária): história familiar de doenças genéticas, abortos recorrentes ou natimorto: idade paterna e história de doenças genéticas.
A história atual da gravidez inclui sangramento uterino anormal, trauma, tratamento reprodutivo, exposição a drogas ou radiação, ganho de peso, infecções, doenças sexualmente transmissíveis, hipertensão, pré-eclâmpsia, diabetes, anemia, anomalia fetal ou restrição de crescimento.
A história obstétrica anterior inclui parto prematuro, natimorto ou feto afetado por restrição de crescimento, bem como qualquer gravidez complicada por pré-eclâmpsia, diabetes, trombose venosa profunda, embolia pulmonar ou uma transfusão de sangue.
O registro de imunização inclui o registro de todas as imunizações concluídas. O teste do estado imunológico pode ser indicado para doenças endêmicas como o sarampo.
A história social inclui emprego, nutrição, uso de substâncias, violência doméstica, histórico de viagens e exposição a qualquer exposição a animais.
Os resultados dos exames laboratoriais pré-natais incluem hemograma completo, tipo e triagem, HbsAg, sífilis, HIV, rubéola, exames pré-natais para aneuploidia, toxicologia urinária, triagem diabética.
Achados do Exame Físico
Examine a paciente para a qual o bem-estar fetal é uma preocupação o mais rapidamente possível para dissipar as preocupações e iniciar o tratamento em tempo hábil. Tente auscultar os batimentos cardíacos fetais com o sonar Doppler fetal e, se indicado, iniciar o monitoramento fetal eletrônico. Se não for possível sonar Doppler para avaliar os batimentos cardíacos fetais, realize uma ultrassonografia abdominal para confirmar a presença ou ausência de batimentos cardíacos fetais o mais rápido possível.
- Vitais- peso, pressão arterial, frequência cardíaca, frequência respiratória, temperatura
- Estado mental – alerta, orientado, confuso, agitado
- Pele: turgor e qualidade do pulso
- Abdômen – sinais de trauma contuso ou agudo, incluindo hematomas ou sangramento, contorno, dor incluindo dor uterina, proteção, sensibilidade de rebote, contrações, sínfise, altura do fundo do útero, manobra de Leopold
- Dor nas costas, Sensibilidade do ângulo costovertebral
- Extremidades – reflexos, edema, erupção cutânea, coceira, petéquias
- Erupção cutânea ou sinais de abuso de drogas
- Pulmonar – falta de ar, taquipnéia, estertores ou estertores
- Frequência cardíaca e ritmo
- Sangramento pélvico, corrimento, avaliação cervical, culturas, testes vaginais (samambaia e exame a fresco)
Depois do Parto
Faça um exame macroscópico do cordão umbilical e da placenta e registre os achados, incluindo medições. Fotografe a placenta e o cordão.
Cultive a placenta conforme indicado esfregando entre a membrana coriônica e amniótica com cotonetes de cultura aeróbia e anaeróbia.
Exame do bebê
Deve-se realizar um exame completo do bebê logo após o nascimento e por um patologista. Um gráfico deve estar disponível para orientar o examinador a registrar cada um dos seguintes marcadores.
- Medidas: peso, comprimento, circunferência da cabeça, comprimento do pé (se menos de 23 semanas, o comprimento do pé pode ser usado para estimar a idade gestacional)
- Características faciais: orelhas, olhos, nariz, boca, crânio.
- Pescoço e costas: higroma cístico, espinha bífida, pigmentação anormal
- Pele: maceração, descamação, cor
- Inserção do cordão: central, marginal, membranosa
- Parede abdominal
- Gênero: ambíguo, feminino, masculino
- Extremidades, dígitos, vincos palmares
- Fotografe a cabeça, rosto, corpo inteiro, mãos e pés. Tire fotos detalhadas do bebê nas direções anterior, posterior e lateral. Fotografe e registre qualquer anormalidade.
Obtenha consentimento para fotografar o bebê e esteja ciente de que algumas culturas, como os Amish, podem não consentir com a fotografia.
Exame da placenta
O exame da placenta é o estudo mais importante, exceto uma autópsia. Pode contribuir para o diagnóstico de natimorto em 53% dos casos. [86]
A avaliação macroscópica da placenta pode ser realizada pelo assistente de parto, um patologista ou ambos. Uma régua, para referenciar as dimensões, deve ser incluída com todas as imagens. [87]
- Reconstitua as membranas para ficarem completas. Tire fotos dos lados fetal e materno da placenta.
- Meça a distância mais curta entre a ruptura da membrana e a borda do disco placentário. Observe o tipo de inserção da membrana (normal, circunmarginada ou circunvalada), cor e brilho.
- Se a gravidez for multifetal, descreva a espessura e a fixação das membranas divisórias ao disco. Observe a localização e o tipo de inserção do cordão umbilical medindo a distância da borda do disco à inserção do cordão.
- Observe o comprimento dos vasos umbilicais desprotegidos, trombos umbilicais intravasculares e o comprimento total do cordão.
- Descreva como o cordão se enrola. Se o enrolamento for uniforme, conte o número de bobinas de 360 graus em um cabo de 5 centímetros. Se o enrolamento não for uniforme, conte todas as bobinas de 360 graus do cabo e divida por todo o comprimento do cordão.
- Documente quaisquer nós ou torções do cabo, falsos ou verdadeiros. Comente sobre edema, hemorragia, laceração ou avulsão do cordão umbilical.
- Corte o cordão a cada 5 centímetros e registre o diâmetro mais espesso e mais fino e o número de artérias / veias em cada segmento.
- Corte o cordão deixando apenas um coto de 1 centímetro do cordão preso à placenta. Pesar a placenta após sua drenagem de sangue.
- Meça a dimensão mais longa e a mais curta da placenta e observe quaisquer lóbulos extras ou forma incomum
- Corte a placenta em tiras de 1 centímetro de largura, deixando 1 centímetro de cada lado do coto umbilical. Meça a espessura total de cada corte e registre a medição mais espessa e mais fina. Examine todas as superfícies.
- Observe as lesões encontradas e tire fotos delas.
Avaliação
Avaliação microscópica da placenta
Pegue blocos de 1 x 1 cm de 4 locais da placenta. Recupere as amostras com o lado materno da placenta voltado para cima e envie as amostras não corrigidas.
Autópsia
Os restos mortais devem ser tratados com respeito e uma autópsia deve ser realizada em tempo hábil para ajudar a família a estabelecer o funeral / enterro. A abordagem para a autópsia de um natimorto não foi padronizada. No entanto, tenha em mente que a documentação de resultados negativos é tão importante quanto a de resultados positivos.
Alguns pacientes e alguns cuidadores podem achar difícil abordar o tópico de uma autópsia de natimorto. A realização de uma autópsia requer consentimento por escrito. O tecido fetal não é considerado parte do produto da concepção após 20 semanas de idade gestacional e, portanto, o seguro pode não cobrir seu exame.
Uma autópsia pode identificar a causa do natimorto em 46% dos casos e pode fornecer novos achados em 51% dos casos. [88] Esse conhecimento pode ser usado para aconselhar pacientes sobre o risco de recorrência e orientar recomendações para cuidados pré-natais futuros.
O patologista com experiência na avaliação de natimortos faz parte integrante da equipe. Se alguém com essa experiência não estiver disponível localmente, o feto e / ou a placenta podem precisar ser transferidos, de acordo com os regulamentos, para outro centro para avaliação.
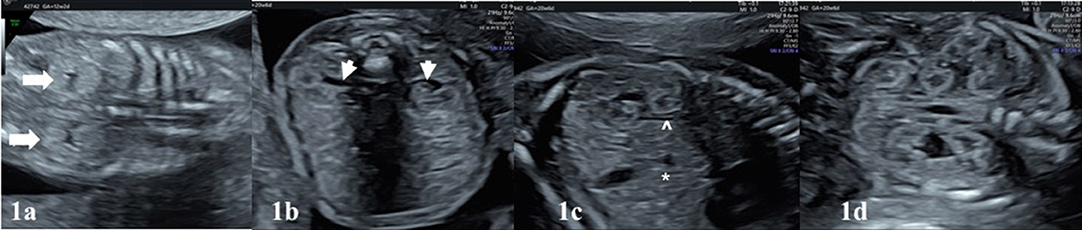
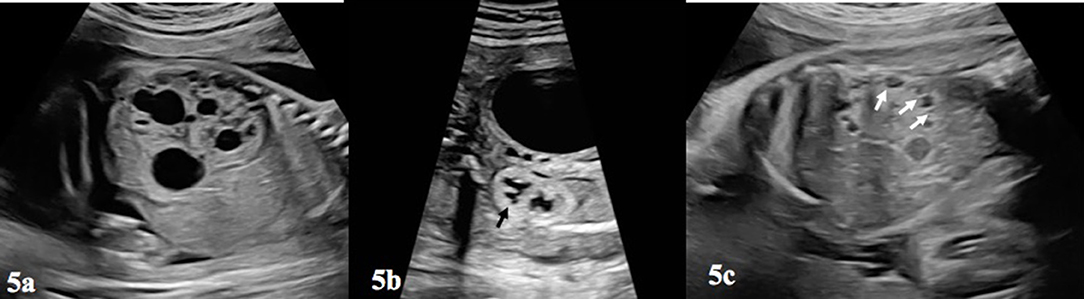
As malformações cardíacas não são detectadas prontamente nas imagens post-mortem e, portanto, uma autópsia é inestimável para avaliá-las. Essas anomalias podem passar despercebidas na ultrassonografia obstétrica de rotina e muitas vezes requerem um ecocardiograma fetal para ser diagnosticado no pré-natal.
Uma autópsia completa inclui um exame do cérebro e dos órgãos internos. Pode incluir a recuperação e preservação de órgãos para estudo posterior; no entanto, mediante solicitação, todos os órgãos podem ser devolvidos ao corpo após a autópsia.
Uma autópsia parcial também pode ser feita. Nesse caso, a família especifica quais cavidades corporais podem ser inseridas. O exame da cabeça pode ser recusado e a família só pode dar consentimento para um exame externo. Algumas famílias aceitam muito mais uma autópsia sabendo dessas informações. [88]
Uma autópsia pode ser realizada em conjunto com estudos radiológicos. A ressonância magnética, a TC ou a ultrassonografia de alta qualidade podem revelar lesões intracavitárias. Se detectadas, essas lesões podem ser avaliadas por meio de uma biópsia por agulha guiada para a triagem de infecção, tumor ou malignidade. Em alguns casos, esses estudos radiológicos podem ajudar a evitar a necessidade de uma autópsia completa.
Uma autópsia pode ajudar a fornecer informações valiosas quando forem encontradas anomalias múltiplas que não correspondem a uma síndrome. Também pode ser usado para avaliar anomalias renais e causas de hidropisia não imune na ausência de higroma cístico.
Devem ser tiradas fotografias de quaisquer anomalias detectadas, uma vez que podem ser revistas em momentos diferentes e por vários membros da equipe de cuidados e ajudam a identificar a causa da natimortalidade e a controlar a gravidez futura.
Imagem
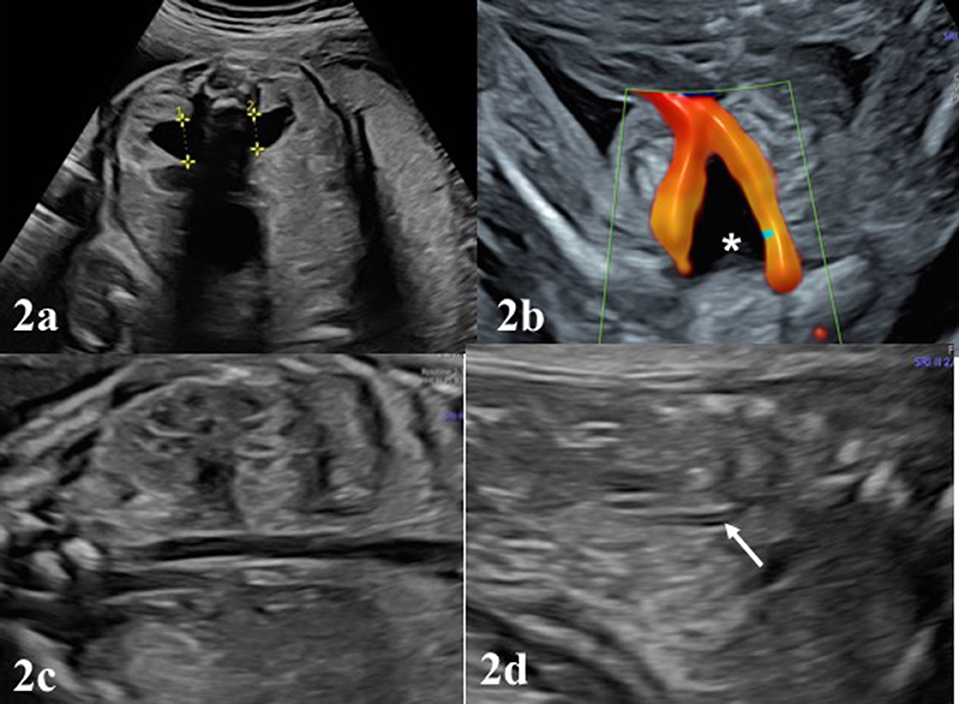
Várias modalidades de imagem podem ser empregadas para ajudar na avaliação da causa da natimortalidade. Um Babygram é uma radiografia lateral e ântero-posterior de todo o feto. Pode revelar displasia esquelética, malformações costovertebrais, calcificações ectópicas e coleções de gases sugestivas de infecção. Este estudo pode confirmar ou sugerir uma causa de natimorto em 16% dos casos e serve como o único método de diagnóstico em 1,5% dos casos. [89] Se a ultrassonografia ou o exame sugerirem um problema esquelético, um levantamento esquelético completo deverá ser realizado. A tomografia computadorizada (TC) é preferida para a avaliação de anormalidades esqueléticas e calcificações ectópicas. A ressonância magnética (MRI) pode permitir o exame de órgãos internos com a detecção de uma anormalidade semelhante à autópsia. [90] Se forem observados defeitos no sistema nervoso central, considere ultrassonografia craniana, ressonância magnética e autópsia. [91]
Estudo Cromossômico
Em 5% dos natimortos de aparência normal, uma anormalidade cromossômica será detectada. [92] Com uma autópsia e um estudo cromossômico, até 35% dos natimortos apresentam uma patologia estrutural importante e 8% têm cromossomos anormais. [93] [40] Após uma avaliação completa, a natimortalidade a termo permanece inexplicada cerca de 30% das vezes. [94] A chance de encontrar uma causa é influenciada pela idade do feto, pela experiência do cuidador e pela profundidade do exame.
O teste cromossômico para aneuploidia deve ser oferecido a todos os natimortos para confirmar ou buscar uma causa para o natimorto. Após 20 semanas de gestação, o “tecido fetal” não é considerado um produto da concepção e, portanto, a avaliação desse tecido pode não ser coberta pelo plano de saúde da mãe. A amniocentese genética ou amostragem de vilo corial antes do parto oferece o maior rendimento (80% a 100%) para análise citogenética bem-sucedida. [31] [95] Secundário à autólise, o sucesso é muito menor (10% a 30%) quando o tecido é obtido após o parto, com o melhor rendimento vindo da placenta ou do cordão umbilical. A amniocentese e a biópsia de vilo corial requerem o consentimento do paciente. O consentimento não é necessário para salvar tecido placentário ou líquido amniótico contendo amniócitos; no entanto, é respeitoso com os pais solicitar seu consentimento.
Como os resultados da amniocentese ainda estão pendentes no momento do parto, amostras de tecido adicionais ainda devem ser obtidas imediatamente após o parto como um back-up para aumentar as chances de obtenção de um resultado.
Se a amniocentese resultar em falha na cultura do tecido, a hibridização fluorescente in situ (FiSH) ainda pode ser realizada para descartar aneuploidia, o benefício da hibridização in situ amniocentese / fluorescência é que ela é mais barata do que o microarray.
O sangue do cordão umbilical coletado para o banco de sangue não é anticoagulado e não é útil para testes citogenéticos. O sangue do cordão umbilical deve ser coletado em um tubo verde ou roxo para o teste citogenético, que contém um anticoagulante (EDTA, heparina).
Evite usar uma biópsia de pele para testes citogenéticos se houver maceração, pois este tecido não dará resultado. O tecido placentário é viável por muito mais tempo do que a pele fetal e deve ser coletado como o produto da concepção de escolha se houver maceração fetal. Tecido viável e não fixo é o preferido. O tecido deve ser colocado em solução de Ringer com lactato e não em formaldeído. Se fixado em formaldeído ou álcool, alguns laboratórios ainda podem oferecer testes genéticos, mas isso não é preferido.
O teste de microarranjo cromossômico (CMT) é agora o teste preferido realizado em tecido coletado do feto ou da placenta após o parto. A pele intacta, a patela ou o tecido costocondral podem ser coletados e submetidos não fixados com solução de lactato em temperatura ambiente. [96] Ele não requer a divisão de células, tornando-o ideal quando as culturas de células falham devido à morte fetal. Ele dá um resultado de 87,4% das vezes. Amostras de sangue obtidas de ambos os pais podem ser usadas para reduzir a incerteza que “variantes genéticas” de significado desconhecido podem criar ao interpretar os resultados para a família. A CMT pode detectar microdeleções e síndromes de microduplicação, além do cariótipo.
O sequenciamento de genes com painéis de sequência total do exoma pode ser realizado em casos com suspeita de displasia esquelética ou morte súbita. Testes para condições de Mendel estão surgindo. Mutações em genes que controlam a morte cardíaca súbita foram descobertas e podem ser encontradas em 10% dos natimortos, que permanecem inexplicáveis apesar de serem submetidos a uma investigação completa. [97] Considere a análise mutacional de KCNQ1 (KV7.1, LQTS tipo 1), KCNH2 (HERG / KV11.1, LQTS tipo 2 e SCN5A (NaV1.5, LQTS tipo 3) usando cromatografia líquida desnaturante de alto desempenho seguida por sequenciamento direto de DNA usando expressão heteróloga e registro patch-clamp. [97] Esses testes não estão prontamente disponíveis em todas as instituições.
Teste de Laboratório
Todos os pacientes devem receber amniocentese se o parto não for iminente, mesmo que uma triagem de DNA livre de células anterior não tenha sido digna de nota.
Todos os pacientes requerem hemograma completo, glicose, bem como tipo e triagem para HIV e sífilis. Eles ajudam a rastrear hemoglobinopatia materna, infecção, controle glicêmico deficiente ou diabetes não diagnosticado e aloimunização de glóbulos vermelhos.
O rastreamento de drogas na urina deve ser considerado, especialmente para cocaína, que tem ligações com hipertensão materna e descolamento prematuro da placenta.
A maioria das trombofilias maternas e fetais não está associada a natimortos e o teste de rotina para trombofilias não é recomendado (Eu, Glaucius discordo). [40] O rastreamento pode ser considerado se houver uma história de restrição de crescimento ou uma história pessoal ou familiar de coágulos sanguíneos. O teste de trombofilias inclui: Fator V Leiden, mutação da protrombina, antitrombina III, MTHFR, proteína C e S. Desses fatores, apenas os níveis de proteína S são afetados pela gravidez e, portanto, a proteína S só deve ser testada três meses após o parto .
Imediatamente após um natimorto, avalie todas as mulheres para hemorragia feto-materna usando o teste de Kleihauer Betke. Este é um teste de diluição que procura eritrócitos fetais na circulação materna e pode ajudar a identificar a causa da natimortalidade. Não é um teste exato, pois usa uma estimativa do volume de sangue materno para calcular a quantidade estimada de sangue fetal transferido para a circulação materna. Se a mãe for Rh-negativa e o feto Rh-positivo, este teste é usado para calcular a dose de Rhogam necessária para prevenir a isoimunização Rh. [98] A citometria de fluxo é um novo teste usado para quantificar a perda de sangue fetal na circulação materna. É um teste muito mais sensível e preciso e deve ser usado em mulheres com RH positivo e RH negativo em qualquer caso de possível hemorragia feto-materna. [99]
Considere o rastreamento de TSH, química hepática e sais biliares se houver suspeita clínica de um problema subjacente. Rastreie anticoagulante lúpico, anticardiolipina IgM e IgG se houver história familiar de coágulos sanguíneos ou se houver evidência de infarto placentário ou arteriopatia.
Triagem para infecção
O rastreamento de infecções é complicado porque muitas mulheres têm sorologia positiva de infecções anteriores. Os patógenos bacterianos mais comuns associados a natimortos são E. coli, Streptococcus do grupo B e espécies de Enterococcus . A maioria dos natimortos relacionados à infecção ocorreu antes de 24 semanas de gestação. [53] Citomegalovírus (CMV) IgM e IgG, Toxoplasmose IgM e IgG, Parvovírus IgM podem ser testados conforme indicação clínica. Os tecidos fetoplacentais apresentarão sinais diagnósticos de infecção viral na histopatologia. Culturas virais raramente são necessárias.
A CMV é a infecção mais comum transmitida no útero. Geralmente, não há achados ultrassonográficos anormais, embora hemorragia cerebral, cardiomegalia, hepatomegalia, ascite leve e intestino ecogênico possam ser relatados. Vasculopatia trombótica é observada na autópsia. O rim é o órgão mais freqüentemente envolvido, e inclusões de CMV podem ser encontradas em células epiteliais na histologia. O DNA do citomegalovírus pode ser encontrado no rim, fígado, cérebro, tireóide, pulmão, coração, pâncreas e placenta.
A infecção intrauterina por herpes é muito rara. 95% das infecções neonatais são adquiridas no periparto. Embora o herpes intrauterino possa ser adquirido durante um surto primário ou secundário, o risco é maior durante uma infecção disseminada por herpes. A transmissão intrauterina é mais comum durante as primeiras 20 semanas de gestação e pode levar a natimortos ou anomalias congênitas. Os achados clínicos podem incluir vesículas ou cicatrizes na pele, lesões oculares (coriorretinite, microftalmia, catarata), danos neurológicos (microcefalia, calcificações intracranianas, convulsões, encefalomalacia). Uma autópsia pode revelar pele ulcerada e necrose do fígado, glândulas adrenais, cérebro e membranas placentárias. A hibridização fluorescente in situ pode confirmar a infecção por herpes.
A infecção por Coxsackievirus pode ser assintomática ou resultar em miocardite fetal, meningoencefalite ou sepse generalizada. Os achados da autópsia podem incluir artrogripose leve, meningoencefalite necrótica com calcificações vasculares, hipertrofia miocárdica leve e vilite placentária monocítica crônica. As técnicas moleculares podem confirmar a infecção.
Culturas placentárias aeróbias, anaeróbicas e de listeria podem ser obtidas se houver indicação clínica. Para prevenir a contaminação, o swab deve ser retirado do espaço potencial que é exposto, separando a membrana coriônica da amniótica. Culturas de bebês natimortos são mais bem obtidas de órgãos internos.
Sífilis: o RPR pode ser positivo por meses após o paciente ser tratado. Os espiroquetas da sífilis infectam a placenta causando aumento das vilosidades, vilosite aguda, funisite necrosante e infecção amniótica. A placentomegalia resulta em natimorto em 50% dos fetos infectados devido à disfunção placentária. O feto infectado pode demonstrar involução do timo, hepatoesplenomegalia e hidropisia. Lesões mucocutâneas são raras. Onde a incidência de sífilis é alta, esta é a principal causa infecciosa de natimortos e tem o maior potencial para melhores resultados se rastreada e tratada. [100]
A malária, em regiões endêmicas, é responsável por um grande número de natimortos devido ao seu efeito danoso na placenta. A profilaxia e o uso de mosquiteiros podem reduzir os natimortos atribuídos a essa infecção.
Triagem para Coagulação Intravascular Disseminada (DIC)
A coagulação intravascular disseminada é muito rara no contexto de natimortos de hoje devido ao diagnóstico e tratamento precoces. Em casos de morte fetal não diagnosticada por mais de três semanas ou em casos de natimortos complicados por descolamento prematuro da placenta ou sepse, pode ser necessário descartar a CIVD. Não existe um único teste laboratorial ou clínico para diagnosticar DIC. Se encontrado no contexto de um natimorto, o tratamento da CIVD inclui o parto do natimorto e o tratamento da hemorragia e / ou sepse; cuidados de suporte com a administração de hemoderivados conforme indicado; fechar vigilância clínica e repetir laboratórios; e resposta rápida / consulta especializada. [101]
Para auxiliar no diagnóstico de CIVD em casos não emergentes em que apenas um diagnóstico clínico pode ser obtido, o EREZ (pontuação ISTH modificado) é recomendado. [101] A pontuação é tabulada somando os pontos atribuídos a (A) a contagem de plaquetas, (B) o PT e (C) o nível de fibrinogênio. Os pontos seguem os valores e estão em negrito. Os produtos de degradação da fibrina são excluídos deste sistema de pontuação, pois aumentam na gravidez e reduzem a especificidade da pontuação.
A) Contagem de plaquetas, (10 ^ 9 / L) <50 = 1 : 50-185 = 2 :> 185 = 0
B) Tempo de protrombina, (segundos) <0,5 = 0 : 0,5-1 = 5 : 1,0-1,5 = 25
C) Fibrinogênio, (gramas / litro) 3,0 = 25 : 3,0-4,0 = 6 : 4,0 – 4,5 = 1 :> 4,5 = 0
Um escore EREZ calculado, obtido pela soma do escore de (A) + (B) + (C), que é maior do que 26, prevê uma alta probabilidade de DIC mesmo na ausência de sintomas clínicos óbvios.
A contagem de plaquetas é o teste mais útil para DIC. A trombocitopenia, ou contagem de plaquetas com tendência decrescente, é o valor laboratorial mais importante a ser observado, mesmo se permanecer acima de 100 x 10 ^ 9 / L.
O TP e o TTP podem se tornar prolongados, mas também podem permanecer normais mesmo no caso de hemorragia aguda e ainda mais no caso de descolamento agudo. Isso é atribuído à alteração dos fatores de coagulação durante a gravidez, o que favorece a trombose. O tratamento para DIC pode, portanto, ser iniciado mesmo quando o TP e o TTP são minimamente prolongados.
Um baixo nível de fibrinogênio é diagnóstico de CIVD e, na gravidez, níveis baixos são incomuns, exceto no caso de uma hemorragia pós-parto maciça. Um nível de fibrinogênio <2 g / L tem um valor preditivo positivo de 100% para progressão para DIC grave. Considere a substituição do fibrinogênio por crioprecipitado quando o nível de fibrinogênio for <1,5 g / L e a substituição das plaquetas quando forem inferiores a 50 x 10 ^ 9 / L e a substituição do plasma fresco congelado (30 mL / kg) quando o PT e o PTT forem prolongados. [101]
Tratamento / Conduta
Comunicar o diagnóstico com os pacientes
A natimortalidade pode ser confirmada por um segundo ultrassonografista conforme necessário. O diagnóstico é transmitido à mãe por um profissional de saúde o mais rápido possível, fazendo todas as tentativas de fornecer privacidade, empatia e apoio. Como isso ocorrerá dependerá da situação. Os ultrassonografistas geralmente entram em contato com o obstetra e marcam uma consulta imediata se o diagnóstico for feito sem aviso prévio. Se o obstetra faz o diagnóstico à beira do leito, o diagnóstico deve ser confirmado imediatamente e comunicado ao paciente. O paciente pode ter a opção de visualizar as imagens de ultrassom com o obstetra. O paciente exigirá apoio compassivo. Alguns pacientes podem precisar sair imediatamente, como mecanismo de enfrentamento e devem ser encorajados a fazê-lo se estiverem clinicamente estáveis. Alguns pacientes podem apreciar uma mão para segurar até que um membro da família chegue para ajudá-lo. A empatia e o apoio são demonstrados ao pedir desculpas e ao oferecer o apoio que o paciente deseja. Isso pode incluir fornecer informações por escrito instruindo o paciente como entrar em contato com você quando estiver pronto e como agendar uma consulta de acompanhamento assim que desejar.
Uma tentativa de obter medidas fetais e rastrear quaisquer anormalidades óbvias pode ser tentada conforme permitido.
É importante dizer ao paciente que ele não fez nada de errado e demonstrar respeito ao bebê chamando-o pelo nome.
Se o paciente não estiver clinicamente estável devido a complicações associadas à morte fetal, deve-se fornecer informações de maneira calma, clara e concisa para obter consentimento informado para qualquer procedimento urgente.
Atendendo às necessidades emocionais
Ao cuidar de um paciente / casal / família que está passando por uma gravidez com natimorto é importante transmitir compaixão, empatia e sensibilidade, ao mesmo tempo em que está atento às suas necessidades emocionais. O diagnóstico de natimorto é frequentemente feito ou confirmado por ultrassom quando há uma incapacidade de detectar batimentos cardíacos fetais ou aleatoriamente no momento de uma ultrassonografia realizada para algo diferente da avaliação de natimorto. A paciente pode ter uma preocupação subjacente com relação ao bem-estar de seu feto ou pode receber esse diagnóstico sem saber. As emoções devem ser validadas. [102] Se necessário, uma consulta de acompanhamento deve ser marcada o mais rápido possível para o paciente. A paciente deve ser encorajada a trazer uma pessoa de apoio com ela. Depois de responder a perguntas imediatas e enfatizar que o paciente não fez nada para causar esse resultado, privacidade e tempo devem ser fornecidos, pois o paciente deseja lidar com as emoções e pedir apoio. Fique com o paciente e forneça suporte emocional pelo tempo que for necessário. Os cinco estágios do luto são negação, raiva, barganha, depressão e aceitação. Qualquer um deles pode ou não ser experimentado no momento do diagnóstico. Se o diagnóstico for feito antes da consulta do paciente, uma consulta deve ser marcada o mais rápido possível. A paciente deve ser encorajada a trazer uma pessoa de apoio com ela.
Comunicar más notícias não é uma habilidade natural, e a capacidade de transmitir más notícias não melhora necessariamente com a experiência. [103] O paciente pode ter uma reação de fuga e precisar sair logo após receber o diagnóstico. Isso deve ser respeitado. A paciente deve ter certeza de que está segura e pode ligar de volta para falar com o obstetra quando estiver pronta. O obstetra deve estar preparado para responder a todas as perguntas feitas, incluindo por que, como, quando, onde e o quê, e ter informações impressas para o paciente levar consigo. O paciente pode solicitar informações sobre o motivo disso. Eles devem ser informados de que exames e testes serão oferecidos para tentar responder a essa pergunta, mas que pode levar várias semanas para coletar as informações necessárias.
Uma cópia do ultrassom pode ser colocada em um envelope lacrado e oferecida ao paciente como lembrança. Pode ser oferecido no momento do exame ou em visitas subsequentes.
A paciente pode perguntar sobre o plano de manejo após o diagnóstico de natimorto, e o obstetra deve estar preparado para transmitir essas informações em um ambiente privativo e confortável. O cuidador deve perguntar se alguma prática religiosa ou cultural precisa ser respeitada.
Conduta
A discussão sobre o tipo de parto dependerá da idade gestacional do natimorto, dos desejos da paciente, do estado físico da paciente e da história obstétrica / cirúrgica anterior. As informações são fornecidas de forma clara e concisa, e a confirmação do entendimento deve ser obtida.
Anormalidades de coagulação causadas por uma liberação de fator de tecido da placenta podem ocorrer se o feto morto for retido por várias semanas. [104] O risco é de cerca de 2% e esse diagnóstico requer intervenção imediata. [105] Na ausência de coagulação intravascular disseminada, infecção ou pré-eclâmpsia com características graves, a mãe / casal pode ir para casa e fazer o acompanhamento para planejar o manejo. Se a conduta expectante for desejada, o trabalho de parto espontâneo geralmente começa dentro de duas semanas após a morte fetal.
Normalmente, o parto vaginal é a via mais segura de parto, mesmo após uma cesariana anterior de segmento inferior. Algumas mulheres podem solicitar uma cesariana primária ou repetida para evitar o parto. Esta é uma opção desde que o paciente esteja totalmente ciente dos riscos versus benefícios.
A natimortalidade antes de 24 semanas é melhor tratada por uma dilatação e evacuação (D&E) por um obstetra competente. Isso envolve a dilatação do colo do útero e a remoção manual do produto da concepção. O colo do útero é frequentemente pré-dilatado com laminaria colocada no colo do útero na noite anterior ao procedimento. O risco do procedimento é maior quando o feto mede mais de 24 semanas de tamanho. Um tamanho fetal estimado por ultrassom inferior a 24 semanas é, portanto, mais importante do que a idade gestacional estimada para determinar a adequação de um D&E. Um feto na ultrassonografia pode ser menor do que a idade gestacional estabelecida devido à restrição de crescimento causada pela patologia subjacente ou ao natimorto anterior ao diagnóstico.[106] Se a D&E não for desejada, uma indução médica do parto é oferecida com misoprostol. Até 26 semanas, dê misoprostol vaginal 100 mcg a cada 6 horas por um máximo de 4 doses. Se a primeira dose não resultar em contrações adequadas, a dose pode ser dobrada até 400 mcg. A dose diária máxima não deve exceder 1600 mcg. [107]
A natimortalidade após 24 semanas com colo uterino favorável (pontuação de Bishop> 6) é realizada com doses padrão de ocitocina sintética.
A natimortalidade após 24 semanas com colo do útero desfavorável (pontuação de Bishop <6) na ausência de cicatriz de histerotomia anterior é obtida com misoprostol 50 mcg por via vaginal repetido a cada 4 horas por um máximo de 6 doses. [108] Se a primeira dose não resultar em uma alteração cervical ou em mais de duas contrações em 10 minutos, a segunda dose pode ser dobrada para 100 mcg por via vaginal e novamente para 200 mcg por via vaginal quatro horas após a dose de 100 mcg. O tempo médio do parto é de 10 a 11 horas. Se o parto não ocorrer em 24 horas, o esquema pode ser repetido uma vez. A ocitocina pode ser substituída assim que o colo do útero atingir 4 cm, se necessário. O monitoramento eletrônico não é usado para indução de morte fetal. O misoprostol não é repetido se houver mais de duas contrações em 10 minutos, devido ao risco de taquissistolia. [109][110]
Protocolos diferentes podem ser seguidos para o parto. Em alguns casos, um balão de foley é usado para amadurecer o colo do útero. Em alguns casos, uma alta dose de [regime de ocitocina é usada. [111]
O parto vaginal não é contra-indicado em gestações com menos de 24 semanas complicadas por placenta prévia. [112] A cesariana é mais segura em gestações complicadas por placenta prévia e natimorto depois de 24 semanas.
Mulheres com parto anterior único, transversal baixo, cesáreo e natimorto no segundo trimestre podem receber agentes de amadurecimento mecânico ou misoprostol menor ou igual a 200 mcg por via vaginal a cada 4 horas. O risco de ruptura é de 0,28 por cento contra 0,04 por cento nessas mulheres sem cesariana anterior. [113]
Mulheres com morte fetal no terceiro trimestre e colo do útero desfavorável e história prévia de cesariana devem usar um método mecânico de amadurecimento cervical seguido de ocitocina para indução. O misoprostol pode ser considerado uma opção somente após consentimento informado rigoroso. A menor dose de 25 a 50 mcg por via vaginal deve ser usada, e a dose não deve ser dobrada para reduzir o risco de ruptura uterina. [114]
A desproporção fetal-pélvica raramente é uma preocupação para o parto de um natimorto, seja pélvico ou cefálico, na ausência de macrossomia. A sobreposição dos ossos do crânio e a deterioração fetal geralmente permitem o nascimento de fetos até grandes. Uma apresentação córmica ou transversa persistente pode exigir uma tentativa de versão interna ou externa. [115] Se malsucedidas, essas apresentações fetais podem exigir um parto cesáreo.
Inteligencia emocional
Para a paciente (e seu apoio), um natimorto é um evento catastrófico. Embora a equipe possa demonstrar empatia, sua experiência não se compara à dos pais. Como resultado, a comunicação pode ser percebida como fria. Enquanto o foco dos cuidadores está na mãe e no futuro, os pais continuam focados no bebê. Os pais podem não entender por que o parto vaginal está sendo recomendado e precisarão de uma comunicação clara para entender por que uma cesariana não é a norma. Parte do cuidado inclui discutir estratégias de enfrentamento e apoiar a variedade de comportamentos normais e apoiará a cura. Os pais podem ser influenciados pela equipe. O aconselhamento em relação à autópsia deve ser feito de forma respeitosa, o que permite que a família entenda seu propósito e cronograma. [116]
No momento do parto, se um nome for escolhido, o bebê deve ser tratado por seu nome. O contato entre a mãe e o natimorto deve ser oferecido; o paciente / família deve ser aconselhado bem antes do parto sobre as coisas para as quais eles precisam se preparar. O desenvolvimento de uma conexão com o bebê torna a morte real, ajuda a evitar o afastamento emocional da perda e ajuda na transição para a paternidade. [117] Os pais podem preferir ver apenas as partes do bebê que são menos incômodas, e roupas e embrulhos adequados para o bebê antes de vê-lo e segurá-lo podem ser oferecidos. Os pais escolhem muitas opções diferentes quanto a ver e segurar seu bebê, e suas escolhas devem ser respeitadas. Em alguns estudos, encorajar o contato com os natimortos tem sido associado ao estresse pós-traumático, ansiedade e depressão.[118] Presentes de memória, como fotografias, uma mecha de cabelo ou uma impressão de mão ou pé, podem ser apreciados quer a mãe / família opte por ficar com o bebê natimorto ou não. [119]
As opções de autópsia, seus benefícios e custos devem ser apresentados de forma sensível, informativa e não tendenciosa. A maioria dos líderes religiosos apóia a autópsia, desde que o sepultamento ocorra dentro de um prazo razoável e os pais sejam devidamente aconselhados. [120] A mãe / família precisa ser auxiliada na decisão sobre a disposição do recém-nascido. A família pode ter a opção de um enterro total às suas custas ou usar o mecanismo do hospital para o tratamento de restos mortais fetais. Nos EUA, isso depende da legislação estadual individual. Os pais são informados de que uma certidão de óbito fetal é emitida no lugar da certidão de nascimento. Isso pode afetar o tempo livre permitido pelos empregadores para a convalescença pós-parto.
Algumas mulheres / famílias não vão querer estar perto de outras novas famílias neste momento. Fotos de recém-nascidos e famílias expostas em sua área de atendimento imediato também podem provocar sentimentos negativos. Todos os esforços devem ser feitos para identificar a perda do paciente, de modo que comentários ou gestos inadvertidos sejam evitados pela equipe responsável. O paciente também deve receber alojamento em uma área longe de recém-nascidos, se solicitado.
O aconselhamento sobre o ingurgitamento mamário, que pode causar dores físicas e emocionais, é essencial. Algumas mães solicitarão informações sobre como interromper a produção de leite o mais rápido possível, enquanto outras podem considerar a doação de leite algo emocionalmente útil.
Se houver outras crianças em casa, elas precisam ser incluídas no processo de luto e cura. A importância de falar sobre o bebê, abordando sentimentos / tristeza e afastando a culpa foi validada. [121] Os cuidadores devem entrar em contato com a mãe / família regularmente para avaliar a depressão pós-parto e a necessidade de encaminhamento. O luto normalmente pode durar mais de três meses. O luto disfuncional deve ser identificado e tratado adequadamente. O casal precisa ser aconselhado de que cada um pode ter mecanismos muito diferentes de enfrentamento e resolução do luto, o que exigirá o respeito e a compreensão um do outro. Os grupos de apoio podem ajudar os casais a se curar após a morte de um bebê, e recursos devem ser fornecidos. [122]
No momento apropriado, as preocupações relacionadas ao planejamento familiar e à gravidez futura podem ser discutidas. Um intervalo entre gestações de menos de seis meses não está associado a um resultado adverso da gravidez na próxima gravidez. [123] [124] Mulheres / casais são aconselhados a tentar engravidar quando estiverem prontos.
Diagnóstico diferencial
Gravidez Viável
Um natimorto deve ser confirmado por ultrassom para descartar um feto vivo. Os batimentos cardíacos fetais podem não ser detectados por um fetoscópio no caso de uma gravidez viável.
Aborto espontâneo
Um natimorto deve ser diferenciado de um aborto espontâneo. A idade gestacional mais precisa é calculada comparando a idade gestacional estimada (IGE) calculada a partir da última menstruação (DUM) com a IGE calculada a partir da ultrassonografia do primeiro trimestre e seguindo as regras de datação estabelecidas. Se a DUM for desconhecido e não houver ultrassom anterior, a IGE pode ser estimado pelo peso ao nascer ou pelo comprimento do pé do feto.
Gravidez Multifetal
Uma gravidez múltipla deve ser excluída no caso de haver um natimorto acompanhado por um feto gêmeo ou trigêmeo vivo.
Doença Materna Subjacente
Aproximadamente 1/17 natimortos estão associados a morbidade materna grave atribuída a doenças maternas. [126] As doenças maternas devem ser diagnosticadas e tratadas para evitar a morbidade ou mortalidade materna. Isso pode incluir doenças como apendicite aguda ou lúpus sistêmico. Outras condições podem incluir placenta prévia ou acreta, hemorragia grave e distúrbios hipertensivos. Essas condições representam o maior risco de morbidade materna e podem progredir para DIC, síndrome da angústia respiratória aguda e insuficiência renal. [7] [127] [128] A necessidade de transfusão de sangue é sete vezes maior após um natimorto do que após um nascido vivo. [129] No prazo de 42 dias após o parto, mais de 15% das mortes maternas nos EUA (1470/10000) são atribuídas a mulheres que tiveram natimortos. [130]
Infecção
As infecções devem ser tratadas de acordo com as diretrizes do CDC.
Agressão física
Trauma contuso no abdome pode resultar em morte fetal. [131] Todos os pacientes devem ser questionados em particular sobre violência por parceiro íntimo e / ou abuso físico. Se houver qualquer sinal de trauma físico, o paciente deve ser questionado sobre esses achados.
Os itens a seguir raramente estão associados a natimortos, mas devem ser considerados.
Envenenamento
A ingestão de drogas, intoxicação alimentar ou exposição a toxinas ambientais, como monóxido de carbono, pode resultar na morte fetal e, se não diagnosticada e tratada, pode contribuir para a morbidade e mortalidade materna.
Gravidez Abdominal
Isso é muito raro e passa despercebido na ultrassonografia em até 45% das vezes. [132] Dada a alta mortalidade materna associada a esse diagnóstico, o plano de manejo é crucial. Se o paciente estiver estável, um natimorto abdominal ectópico pode ser tratado com observação cuidadosa para permitir a involução dos vasos placentários e para reduzir o risco de hemorragia. No caso de instabilidade materna, pode ser necessária uma cirurgia de emergência. A remoção da placenta pode resultar em hemorragia. A placenta deve ser deixada no local apenas se o risco de hemorragia for muito grande para tentar a remoção, pois aumenta o risco de sepse pós-operatória. Se a placenta for deixada in situ, o cordão umbilical é amarrado com uma sutura com fio absorvível e cortado ao nível da placenta. O metotrexato usado para acelerar a reabsorção da placenta não é recomendado, uma vez que a rápida deterioração do tecido pode aumentar o risco de infecção materna.[133] [134] [135] [136]
Ruptura uterina
Isso foi documentado durante a indução médica para natimorto em uma paciente sem história anterior de cirurgia uterina e deve ser considerado se indicado pelos sintomas da paciente. [137]
Gravidez Molar Parcial
Este feto tem 69 cromossomos e pode se apresentar como natimorto. A triploidia é um distúrbio fatal. Ocasionalmente, um feto triploide pode sobreviver por vários meses após o nascimento. Muito raramente, devido ao mosaicismo, o feto pode ser diplóide e a placenta triploide. Uma gravidez molar está associada a um risco maior de pré-eclâmpsia e hemorragia pós-parto. A prevenção da gravidez e a vigilância do Bhcg quantitativo por até um ano são necessárias para a triagem de doença trofoblástica gestacional persistente. [138] [139]
Estudos pertinentes e testes em andamento
Um estudo que avaliou gravidezes entre 35 e 37 semanas demonstrou que os marcadores bioquímicos fornecem uma estimativa pobre de natimortos em fetos pequenos para a idade gestacional e não pequenos para a idade gestacional. [140] Embora os marcadores bioquímicos sejam bons em prever fetos pequenos para a idade gestacional e pré-eclâmpsia, eles não são bons em prever natimortos entre 30 a 34 semanas. [141]
No entanto, o nível de fator de crescimento placentário (PIGF) quando baixo no final da gravidez está fortemente associado a fetos pequenos para a idade gestacional, pré-eclâmpsia, comprometimento fetal, admissões em UTIN e natimorto. Esta proteína angiogênica é produzida na placenta e contribui para o desenvolvimento de uma circulação de baixa resistência na placenta. Normalmente, o nível atinge o pico em 30 semanas e, em seguida, cai no final. Um nível baixo no primeiro e segundo trimestres impacta negativamente o desenvolvimento da placenta. A capacidade de prever resultados adversos da gravidez com base em um nível baixo no terceiro trimestre está sendo avaliada. Muitos estudos usam a proporção de tirosina quinase-1 solúvel em fms (sFlt-1) / proporção de PlGF em vez de apenas o nível de PlGF. O desempenho da triagem dessas medidas está sendo avaliado para prever resultados adversos da gravidez. Nesse momento,[142] Os dados mostram que um baixo PIGF ou um aumento da proporção sFlt-1: PIGF estão associados a resultados adversos da gravidez, natimortos e restrição de crescimento fetal. [143] Apesar desta associação, não há evidência de que os marcadores bioquímicos sozinhos são insuficientes para identificar fetos em risco para a restrição do crescimento ou morte fetal. [144]
A indução do parto com 39 semanas ou mais para reduzir a taxa de natimortos está sendo avaliada. A indução do parto após 39 semanas está associada a menos mortes perinatais, menos cesarianas, menos admissões em UTIN e baixos índices de Apgar. Um valor de 426 induções em ou além de 39 semanas é estimado para prevenir uma morte perinatal. O momento ideal para a indução requer mais pesquisas. [145]
Planejamento de Tratamento
Estratégias de prevenção
Estratégias de rastreamento e monitoramento para prevenir natimortalidade são controversas. É apropriado monitorar pacientes com condições que aumentam o risco de natimortalidade com alguma forma de teste pré-natal durante o atendimento pré-parto. No entanto, os obstetras devem estar cientes de que as taxas de falso-positivo são altas para a maioria dos testes. O uso global intraparto de cardiotocografia e a capacidade de realizar cesariana para batimentos cardíacos fetais não tranquilizadores levaram a uma diminuição nas taxas de natimortos em países desenvolvidos. Este recurso deve ser disponibilizado em países de baixa e média renda, onde ocorre a maioria dos natimortos.
Os sistemas de pontuação de risco têm boa sensibilidade, mas um valor preditivo pobre quando se trata de prever resultados negativos do nascimento. [146] Mais pesquisas são necessárias nessa área.
Não há evidências de que o monitoramento da contagem de chutes fetais (mobilograma) seja útil em todas as gestações ou ajude a prevenir natimortos. [147] Apesar disso, a contagem do movimento fetal é recomendada para gestações de alto risco, especialmente se houver suspeita de restrição de crescimento ou insuficiência placentária. [148] [149]
Embora o ultrassom na gravidez tenha vários benefícios, o uso rotineiro do ultrassom na gravidez não demonstrou benefícios na redução da natimortalidade. [150]
Foi demonstrado que o Doppler da artéria uterina identifica fetos com restrição de crescimento intrauterino sob risco de natimorto, mas essa identificação requer medidas oportunas e apropriadas para prevenir natimortos, o que requer pesquisas contínuas. [151]
A incidência de natimortos não é afetada pelo uso de pelvimetria, mas a taxa de cesarianas aumenta. [152]
Diabetes na gravidez justifica triagem e tratamento visando manter o controle da glicose para reduzir natimortos, especialmente em populações onde a prevalência de diabetes é alta. O controle pré-gestacional do diabetes tem o maior benefício na redução do risco de natimortalidade. O risco de natimortos não aumenta em mulheres com bom controle do diabetes e sem evidência de vasculopatia diabética. [153]
Nos EUA, uma redução na taxa de natimortos foi observada quando a cardiotocografia / teste sem estresse (NST) foi introduzido para o manejo de gestações de alto risco. [154] No entanto, há uma alta prevalência de testes não reativos falso-positivos. Para prever resultados adversos da gravidez, o perfil biofísico (PBF) tem uma taxa baixa de falso-negativo, mas uma alta taxa de falso-positivo e é comparável à cardiotocografia / NST. O perfil biofísico modificado (PBFM), que inclui um teste sem estresse e uma medição do índice de líquido amniótico, é tão confiável e muito mais fácil de realizar do que o perfil biofísico completo. [155] O perfil biofísico modificado é considerado anormal se o teste sem estresse for não reativo ou se a maior bolsão vertical do líquido amniótico for menor que 2 cm. Embora faltem evidências para apoiar a capacidade do PBF e PBFM de reduzir a natimortalidade, o Colégio Americano de Obstetrícia e Ginecologia apóia o início do teste não antes de 32 semanas e 0 dias de gestação para gestações de alto risco e antes apenas se o parto for considerado impacto benefício perinatal. [156] [157]
Embora a estimulação vibroacústica possa ajudar a reduzir o tempo de teste para cardiotocografia e a incidência de testes não reativos, ela não demonstrou reduzir as taxas de natimortos. [158] [159]
Embora o poliidrâmnio esteja associado a um risco aumentado de natimorto, o benefício de diagnosticar o poliidrâmnio para reduzir a taxa de natimortos é incerto e requer estudos adicionais. [160] Oligoidrâmnio está associado a um risco elevado de natimortalidade. É uma medida subjetiva e dinâmica que pode melhorar com a administração de infusão intravenosa de solução salina hipotônica. O uso do maior bolsão vertical é comparável à medição dos quatro quadrantes, mas reduz o diagnóstico falso-positivo de oligoidrâmnio e se tornou o método preferido para rastrear a quantidade de líquido amniótico. [161] [162]
Os cuidados domiciliares para gestações complicadas por doença hipertensiva da gravidez sem proteinúria (Hipertensão Gestacional) e gestações múltiplas não parecem ser inferiores aos cuidados hospitalares. [163] A admissão em unidades de vigilância fetal intra-hospitalar não é recomendada, pois não foi comprovado que isso reduza a mortalidade perinatal. [164]
Em comparação com nenhuma ausculta ou ausculta intermitente em mulheres de baixo risco, a cardiotocografia de admissão foi associada a taxas mais altas de cesárea e menos convulsões neonatais, mas nenhuma melhora nas taxas de natimortos. [165]
Um eletrocardiograma fetal ou oximetria de pulso, além da cardiotocografia, não demonstrou prevenir a natimortalidade. [166] [167]
Prognóstico
O acompanhamento de uma mulher após o tratamento de um natimorto inclui aconselhamento sobre o risco de recorrência. Depois de um natimorto, o risco de recorrência é quase duas vezes maior do que o de mulheres nascidas vivas. Este risco é impactado por vários fatores, incluindo riscos maternos, idade gestacional e causa (s) identificada (s) para o natimorto. [168] Em mulheres com natimortos inexplicáveis, o risco de recorrência é de 7,8 a 10,5 por 1.000 nascimentos totais. A maioria ocorre antes de 37 semanas. O risco de morte fetal recorrente a termo é de 1,8 / 1000 nascimentos totais. A próxima gravidez também está em risco de baixo peso ao nascer, descolamento e parto prematuro. Uma história de um natimorto pequeno para a idade gestacional a termo teria um risco recorrente de natimorto de 4,7 por 1000 nascimentos em sua próxima gravidez contra 2,1 por 1000 nascimentos se o bebê pequeno para a idade gestacional fosse nascido vivo. Se uma causa específica para natimorto for encontrada, uma revisão da literatura pode estimar o risco de outro natimorto. Se o bebê natimorto tiver um defeito congênito identificado, o risco de a próxima gravidez apresentar o mesmo defeito aumenta 7,6 vezes e o risco de um defeito diferente no próximo bebê aumenta 1. 5 vezes em comparação com mulheres cujo filho anterior era estruturalmente normal. Os distúrbios isquêmicos da placenta que resultam em descolamento, restrição do crescimento fetal, pré-eclâmpsia e natimorto predispõem ao nascimento prematuro. As mulheres que tiveram um parto anterior pequeno para a idade gestacional, prematuro, nascido vivo têm maior risco de natimorto na gravidez seguinte.[9] [169] Uma mulher pode atrasar a gravidez futura até sentir que atingiu o fechamento e a estabilidade psicológica após o parto morto. O intervalo típico é de 6 a 12 meses. [170] Não há um período ideal definido para atrasar a gestação. O intervalo pode depender da via de parto e de vários outros fatores vitais.
Complicações
Após um natimorto, as complicações físicas podem incluir passagem incompleta do produto da concepção que requer tratamento médico ou cirúrgico, infecção, hemorragia, coagulação intravascular disseminada, lesão uterina que requer reparo cirúrgico ou histerectomia. Existe um risco aumentado de natimortos recorrentes no futuro.
Com base nos fatores de risco identificados no momento de natimortos, como pré-eclâmpsia ou diabetes, o paciente pode ter um risco aumentado de desenvolver doenças cardiovasculares no futuro. Se a síndrome anticardiolipina for identificada durante a avaliação de um natimorto, a mulher pode correr risco futuro de ter um acidente vascular cerebral ou trombose venosa profunda (TVP).
Os estressores psicossociais podem incluir perda de emprego ou renda e os encargos financeiros dos custos de saúde incorridos no tratamento desta complicação da gravidez. Depressão, ansiedade e transtorno pós-traumático podem surgir associados a luto e / ou culpa não resolvidos. A disfunção de relacionamento pode ser experimentada e complicada pelo estigma associado de ser incapaz de dar à luz uma criança saudável. Mecanismos de enfrentamento incongruentes entre a paciente e seu parceiro podem levar à discórdia. A paciente pode desenvolver medo de ter uma gravidez futura, o que pode levar à decisão de evitar uma gravidez futura. A resolução disfuncional do luto pode surgir em outros membros da família, incluindo crianças mais novas em casa.
Dissuasão e educação do paciente
A detecção precoce e o manejo eficaz das doenças maternas são necessários para melhorar os resultados da gravidez. A melhoria dos cuidados pré-natais e durante o parto pode ajudar a reduzir os natimortos.
Apenas alguns fatores de risco identificados para natimortos são considerados modificáveis. O IMC materno e o controle da glicose podem ser modificados em mulheres com diabetes para reduzir o risco de aborto espontâneo recorrente. Dado que muitos natimortos nesta população ocorrem a termo, a mudança no cuidado pré-natal e um parto prematuro planejado podem impactar o risco. [169] [171] [172] Manter os níveis ideais de glicose no sangue é o objetivo. [22] É difícil prever qual gravidez pode ser adversamente afetada, uma vez que a sobreposição nos valores de IMC materno e de glicose no sangue materno em gestações que resultam em nascimento vivo e natimorto é grande.
O uso de tabaco e drogas recreativas são fatores de risco modificáveis adicionais. A triagem universal para abuso de substâncias é apoiada e as mulheres com necessidades identificadas devem ser encaminhadas para receber tratamento, se desejado. Os objetivos do tratamento são revisar sua autoeficácia e o que eles tentaram no passado, reconhecer que existem diferentes opções de vida e identificar que eles merecem uma vida melhor. Isso é alcançado com a ajuda de unidades de saúde mental, especialistas em transtornos por uso de substâncias e o uso de treinadores de recuperação de dependência. [173]
Para gravidez complicada por colestase obstétrica (CO), o parto planejado com 37 a 38 semanas de gestação deve ser substituído por decisões individualizadas, dados os riscos perinatais conhecidos de parto prematuro e a falta de evidências que associam CO com risco de natimorto. [174]
As auditorias perinatais podem ajudar a reduzir a taxa de natimortos. [175] [176] Isso dependerá da precisão e confiabilidade do registro e recuperação de informações de natimortos de registros de parto ou nascimento.
Melhorar os resultados da equipe de saúde
É necessário investir na prevenção da natimortalidade. A natimortalidade deve ser integrada às iniciativas de saúde de mulheres e crianças em todo o mundo. É preciso haver liderança intencional; os campeões devem ser identificados para agir, educar e fazer mudanças. A voz das mulheres deve ser ouvida e ter defensores. Devemos estar preparados para investir em intervenções e devem ser implantados indicadores que nos permitam medir o sucesso de nossas ações.
A natimortalidade precisa ser claramente definida. Cada morte deve ser contada e as ações para prevenir essas mortes devem ser rastreadas e monitoradas. Cuidados obstétricos e obstétricos de alta qualidade devem estar universalmente disponíveis. O parto deve ser realizado com atendentes qualificados, que realizem partos vaginais assistidos e cesáreas por indicação fetal e materna. De todos os natimortos, metade ocorre durante o nascimento. Setenta e cinco por cento deles são evitáveis com acesso a cuidados de qualidade. A capacidade de fornecer indução do parto para ruptura prematura de membranas e gravidez pós-termo precisa ser abordada. [177]
Mulheres que vivenciaram natimortos precisam de reconhecimento social, e devemos trabalhar para abolir o estigma de longo prazo de natimortos que serve apenas para degradar as mulheres e esconder seu fardo. Os cuidados respeitosos e de suporte são essenciais, incluindo os cuidados ao luto após um parto morto.
A natimortalidade pode ser evitada abordando e tratando infecções, desnutrição, doenças não transmissíveis, fatores de estilo de vida, trabalho de parto prematuro e parto pós-termo. Abordar o controle da natalidade em adolescentes, o espaçamento da gravidez e a pobreza também será benéfico. Devemos nos esforçar para fornecer a todas as mulheres acesso ao planejamento familiar e a recursos, que podem ajudar a preparar mulheres de todas as idades para a gravidez. Isso inclui o fornecimento de assistência e suporte pré-natal eficazes: suplementação de ácido fólico, tratamento intermitente de DSTs (sífilis), aconselhamento para parar de fumar, triagem e gestão de doenças maternas e a detecção e gestão da restrição de crescimento fetal identificada o mais cedo possível na gravidez.
Devemos promover a investigação de natimortos como parte da revisão por pares. [177] Isso requer a colaboração de mentes voltadas para a saúde e o bem-estar de mulheres e crianças em um dos momentos mais vulneráveis de suas vidas.
Referências Bibliográficas
1.Martin JA, Hoyert DL. The national fetal death file. Semin Perinatol. 2002 Feb;26(1):3-11. [PubMed]
2.Lawn JE, Blencowe H, Waiswa P, Amouzou A, Mathers C, Hogan D, Flenady V, Frøen JF, Qureshi ZU, Calderwood C, Shiekh S, Jassir FB, You D, McClure EM, Mathai M, Cousens S., Lancet Ending Preventable Stillbirths Series study group. Lancet Stillbirth Epidemiology investigator group. Stillbirths: rates, risk factors, and acceleration towards 2030. Lancet. 2016 Feb 06;387(10018):587-603. [PubMed]
3.Man J, Hutchinson JC, Heazell AE, Ashworth M, Levine S, Sebire NJ. Stillbirth and intrauterine fetal death: factors affecting determination of cause of death at autopsy. Ultrasound Obstet Gynecol. 2016 Nov;48(5):566-573. [PubMed]
4.Lawn JE, Blencowe H, Pattinson R, Cousens S, Kumar R, Ibiebele I, Gardosi J, Day LT, Stanton C., Lancet’s Stillbirths Series steering committee. Stillbirths: Where? When? Why? How to make the data count? Lancet. 2011 Apr 23;377(9775):1448-63. [PubMed]
5.Silver RM, Varner MW, Reddy U, Goldenberg R, Pinar H, Conway D, Bukowski R, Carpenter M, Hogue C, Willinger M, Dudley D, Saade G, Stoll B. Work-up of stillbirth: a review of the evidence. Am J Obstet Gynecol. 2007 May;196(5):433-44. [PMC free article] [PubMed]
6.Reinebrant HE, Leisher SH, Coory M, Henry S, Wojcieszek AM, Gardener G, Lourie R, Ellwood D, Teoh Z, Allanson E, Blencowe H, Draper ES, Erwich JJ, Frøen JF, Gardosi J, Gold K, Gordijn S, Gordon A, Heazell A, Khong TY, Korteweg F, Lawn JE, McClure EM, Oats J, Pattinson R, Pettersson K, Siassakos D, Silver RM, Smith G, Tunçalp Ö, Flenady V. Making stillbirths visible: a systematic review of globally reported causes of stillbirth. BJOG. 2018 Jan;125(2):212-224. [PubMed]
7.Stillbirth Collaborative Research Network Writing Group. Causes of death among stillbirths. JAMA. 2011 Dec 14;306(22):2459-68. [PMC free article] [PubMed]
8.Sharma PP, Salihu HM, Oyelese Y, Ananth CV, Kirby RS. Is race a determinant of stillbirth recurrence? Obstet Gynecol. 2006 Feb;107(2 Pt 1):391-7. [PubMed]
9.Surkan PJ, Stephansson O, Dickman PW, Cnattingius S. Previous preterm and small-for-gestational-age births and the subsequent risk of stillbirth. N Engl J Med. 2004 Feb 19;350(8):777-85. [PubMed]
10.Malacova E, Regan A, Nassar N, Raynes-Greenow C, Leonard H, Srinivasjois R, W Shand A, Lavin T, Pereira G. Risk of stillbirth, preterm delivery, and fetal growth restriction following exposure in a previous birth: systematic review and meta-analysis. BJOG. 2018 Jan;125(2):183-192. [PubMed]
11.Smith GC, Shah I, White IR, Pell JP, Dobbie R. Previous preeclampsia, preterm delivery, and delivery of a small for gestational age infant and the risk of unexplained stillbirth in the second pregnancy: a retrospective cohort study, Scotland, 1992-2001. Am J Epidemiol. 2007 Jan 15;165(2):194-202. [PubMed]
12.Flenady V, Koopmans L, Middleton P, Frøen JF, Smith GC, Gibbons K, Coory M, Gordon A, Ellwood D, McIntyre HD, Fretts R, Ezzati M. Major risk factors for stillbirth in high-income countries: a systematic review and meta-analysis. Lancet. 2011 Apr 16;377(9774):1331-40. [PubMed]
13.Zile I, Ebela I, Rumba-Rozenfelde I. Maternal Risk Factors for Stillbirth: A Registry-Based Study. Medicina (Kaunas). 2019 Jul 01;55(7) [PMC free article] [PubMed]
14.Getahun D, Ananth CV, Kinzler WL. Risk factors for antepartum and intrapartum stillbirth: a population-based study. Am J Obstet Gynecol. 2007 Jun;196(6):499-507. [PubMed]
15.Ego A, Subtil D, Grange G, Thiebaugeorges O, Senat MV, Vayssiere C, Zeitlin J. Customized versus population-based birth weight standards for identifying growth restricted infants: a French multicenter study. Am J Obstet Gynecol. 2006 Apr;194(4):1042-9. [PubMed]
16.Hoskins IA, Friedman DM, Frieden FJ, Ordorica SA, Young BK. Relationship between antepartum cocaine abuse, abnormal umbilical artery Doppler velocimetry, and placental abruption. Obstet Gynecol. 1991 Aug;78(2):279-82. [PubMed]
17.Pauli RM, Reiser CA, Lebovitz RM, Kirkpatrick SJ. Wisconsin Stillbirth Service Program: I. Establishment and assessment of a community-based program for etiologic investigation of intrauterine deaths. Am J Med Genet. 1994 Apr 01;50(2):116-34. [PubMed]
18.Vintzileos AM, Ananth CV, Smulian JC, Scorza WE, Knuppel RA. Prenatal care and black-white fetal death disparity in the United States: heterogeneity by high-risk conditions. Obstet Gynecol. 2002 Mar;99(3):483-9. [PubMed]
19.Dunne F, Brydon P, Smith K, Gee H. Pregnancy in women with Type 2 diabetes: 12 years outcome data 1990-2002. Diabet Med. 2003 Sep;20(9):734-8. [PubMed]
20.Syed M, Javed H, Yakoob MY, Bhutta ZA. Effect of screening and management of diabetes during pregnancy on stillbirths. BMC Public Health. 2011 Apr 13;11 Suppl 3:S2. [PMC free article] [PubMed]
21.Fretts RC, Schmittdiel J, McLean FH, Usher RH, Goldman MB. Increased maternal age and the risk of fetal death. N Engl J Med. 1995 Oct 12;333(15):953-7. [PubMed]
22.Mackin ST, Nelson SM, Wild SH, Colhoun HM, Wood R, Lindsay RS., SDRN Epidemiology Group and Scottish Diabetes Group Pregnancy subgroup. Factors associated with stillbirth in women with diabetes. Diabetologia. 2019 Oct;62(10):1938-1947. [PMC free article] [PubMed]
23.Salihu HM, Dunlop AL, Hedayatzadeh M, Alio AP, Kirby RS, Alexander GR. Extreme obesity and risk of stillbirth among black and white gravidas. Obstet Gynecol. 2007 Sep;110(3):552-7. [PubMed]
24.Catalano PM. Management of obesity in pregnancy. Obstet Gynecol. 2007 Feb;109(2 Pt 1):419-33. [PubMed]
25.Nohr EA, Bech BH, Davies MJ, Frydenberg M, Henriksen TB, Olsen J. Prepregnancy obesity and fetal death: a study within the Danish National Birth Cohort. Obstet Gynecol. 2005 Aug;106(2):250-9. [PubMed]
26.Merc MD, Lučovnik M, Bregar AT, Verdenik I, Tul N, Blickstein I. Stillbirths in women with pre-gravid obesity. J Perinat Med. 2019 Apr 24;47(3):319-322. [PubMed]
27.Jacob L, Kostev K, Kalder M. Risk of stillbirth in pregnant women with obesity in the United Kingdom. Obes Res Clin Pract. 2016 Sep – Oct;10(5):574-579. [PubMed]
28.Reddy UM, Ko CW, Willinger M. Maternal age and the risk of stillbirth throughout pregnancy in the United States. Am J Obstet Gynecol. 2006 Sep;195(3):764-70. [PubMed]
29.Astolfi P, De Pasquale A, Zonta L. Late childbearing and its impact on adverse pregnancy outcome: stillbirth, preterm delivery and low birth weight. Rev Epidemiol Sante Publique. 2005 Nov;53 Spec No 2:2S97-105. [PubMed]
30.Liu S, Joseph KS, Kramer MS, Allen AC, Sauve R, Rusen ID, Wen SW., Fetal and Infant Health Study Group of the Canadian Perinatal Surveillance System. Relationship of prenatal diagnosis and pregnancy termination to overall infant mortality in Canada. JAMA. 2002 Mar 27;287(12):1561-7. [PubMed]
31.Korteweg FJ, Bouman K, Erwich JJ, Timmer A, Veeger NJ, Ravisé JM, Nijman TH, Holm JP. Cytogenetic analysis after evaluation of 750 fetal deaths: proposal for diagnostic workup. Obstet Gynecol. 2008 Apr;111(4):865-74. [PubMed]
32.Urhoj SK, Andersen PK, Mortensen LH, Davey Smith G, Nybo Andersen AM. Advanced paternal age and stillbirth rate: a nationwide register-based cohort study of 944,031 pregnancies in Denmark. Eur J Epidemiol. 2017 Mar;32(3):227-234. [PubMed]
33.Bjørnholt SM, Leite M, Albieri V, Kjaer SK, Jensen A. Maternal smoking during pregnancy and risk of stillbirth: results from a nationwide Danish register-based cohort study. Acta Obstet Gynecol Scand. 2016 Nov;95(11):1305-1312. [PubMed]
34.Hyland A, Piazza KM, Hovey KM, Ockene JK, Andrews CA, Rivard C, Wactawski-Wende J. Associations of lifetime active and passive smoking with spontaneous abortion, stillbirth and tubal ectopic pregnancy: a cross-sectional analysis of historical data from the Women’s Health Initiative. Tob Control. 2015 Jul;24(4):328-35. [PubMed]
35.Denny CH, Acero CS, Naimi TS, Kim SY. Consumption of Alcohol Beverages and Binge Drinking Among Pregnant Women Aged 18-44 Years – United States, 2015-2017. MMWR Morb Mortal Wkly Rep. 2019 Apr 26;68(16):365-368. [PMC free article] [PubMed]
36.Miller CB, Wright T. Investigating Mechanisms of Stillbirth in the Setting of Prenatal Substance Use. Acad Forensic Pathol. 2018 Dec;8(4):865-873. [PMC free article] [PubMed]
37.Hughes DS, Magann EF. Antenatal fetal surveillance “Assessment of the AFV”. Best Pract Res Clin Obstet Gynaecol. 2017 Jan;38:12-23. [PubMed]
38.Battarbee AN, Sinkey RG, Harper LM, Oparil S, Tita ATN. Chronic hypertension in pregnancy. Am J Obstet Gynecol. 2020 Jun;222(6):532-541. [PubMed]
39.Heinke D, Nestoridi E, Hernandez-Diaz S, Williams PL, Rich-Edwards JW, Lin AE, Van Bennekom CM, Mitchell AA, Nembhard WN, Fretts RC, Roberts DJ, Duke CW, Carmichael SL, Yazdy MM., National Birth Defects Prevention Study. Risk of Stillbirth for Fetuses With Specific Birth Defects. Obstet Gynecol. 2020 Jan;135(1):133-140. [PMC free article] [PubMed]
40.Pauli RM, Reiser CA. Wisconsin Stillbirth Service Program: II. Analysis of diagnoses and diagnostic categories in the first 1,000 referrals. Am J Med Genet. 1994 Apr 01;50(2):135-53. [PubMed]
41.Magann EF, Chauhan SP, Doherty DA, Lutgendorf MA, Magann MI, Morrison JC. A review of idiopathic hydramnios and pregnancy outcomes. Obstet Gynecol Surv. 2007 Dec;62(12):795-802. [PubMed]
42.Brady K, Polzin WJ, Kopelman JN, Read JA. Risk of chromosomal abnormalities in patients with idiopathic polyhydramnios. Obstet Gynecol. 1992 Feb;79(2):234-8. [PubMed]
43.Tasew H, Zemicheal M, Teklay G, Mariye T. Risk factors of stillbirth among mothers delivered in public hospitals of Central Zone, Tigray, Ethiopia. Afr Health Sci. 2019 Jun;19(2):1930-1937. [PMC free article] [PubMed]
44.Pri-Paz S, Khalek N, Fuchs KM, Simpson LL. Maximal amniotic fluid index as a prognostic factor in pregnancies complicated by polyhydramnios. Ultrasound Obstet Gynecol. 2012 Jun;39(6):648-53. [PubMed]
45.Biggio JR, Wenstrom KD, Dubard MB, Cliver SP. Hydramnios prediction of adverse perinatal outcome. Obstet Gynecol. 1999 Nov;94(5 Pt 1):773-7. [PubMed]
46.Pilliod RA, Page JM, Burwick RM, Kaimal AJ, Cheng YW, Caughey AB. The risk of fetal death in nonanomalous pregnancies affected by polyhydramnios. Am J Obstet Gynecol. 2015 Sep;213(3):410.e1-6. [PubMed]
47.Morris RK, Meller CH, Tamblyn J, Malin GM, Riley RD, Kilby MD, Robson SC, Khan KS. Association and prediction of amniotic fluid measurements for adverse pregnancy outcome: systematic review and meta-analysis. BJOG. 2014 May;121(6):686-99. [PubMed]
48.Rossi AC, Prefumo F. Perinatal outcomes of isolated oligohydramnios at term and post-term pregnancy: a systematic review of literature with meta-analysis. Eur J Obstet Gynecol Reprod Biol. 2013 Jul;169(2):149-54. [PubMed]
49.Karahanoglu E, Akpinar F, Demirdag E, Yerebasmaz N, Ensari T, Akyol A, Ulubas Isik D, Yalvac S. Obstetric outcomes of isolated oligohydramnios during early-term, full-term and late-term periods and determination of optimal timing of delivery. J Obstet Gynaecol Res. 2016 Sep;42(9):1119-24. [PubMed]
50.Bililign Yimer N, Tenaw Z, Solomon K, Mulatu T. Inadequate Prenatal Visit and Home Delivery as Determinants of Perinatal Outcomes: Does Parity Matter? J Pregnancy. 2019;2019:9024258. [PMC free article] [PubMed]
51.Bell R, Glinianaia SV, Rankin J, Wright C, Pearce MS, Parker L. Changing patterns of perinatal death, 1982-2000: a retrospective cohort study. Arch Dis Child Fetal Neonatal Ed. 2004 Nov;89(6):F531-6. [PMC free article] [PubMed]
52.Sairam S, Costeloe K, Thilaganathan B. Prospective risk of stillbirth in multiple-gestation pregnancies: a population-based analysis. Obstet Gynecol. 2002 Oct;100(4):638-41. [PubMed]
53.Page JM, Bardsley T, Thorsten V, Allshouse AA, Varner MW, Debbink MP, Dudley DJ, Saade GR, Goldenberg RL, Stoll B, Hogue CJ, Bukowski R, Conway D, Reddy UM, Silver RM. Stillbirth Associated With Infection in a Diverse U.S. Cohort. Obstet Gynecol. 2019 Dec;134(6):1187-1196. [PubMed]
54.Copper RL, Goldenberg RL, DuBard MB, Davis RO. Risk factors for fetal death in white, black, and Hispanic women. Collaborative Group on Preterm Birth Prevention. Obstet Gynecol. 1994 Oct;84(4):490-5. [PubMed]
55.Menendez C, Castillo P, Martínez MJ, Jordao D, Lovane L, Ismail MR, Carrilho C, Lorenzoni C, Fernandes F, Nhampossa T, Hurtado JC, Navarro M, Casas I, Santos Ritchie P, Bandeira S, Mocumbi S, Jaze Z, Mabota F, Munguambe K, Maixenchs M, Sanz A, Mandomando I, Nadal A, Goncé A, Muñoz-Almagro C, Quintó L, Vila J, Macete E, Alonso P, Ordi J, Bassat Q. Validity of a minimally invasive autopsy for cause of death determination in stillborn babies and neonates in Mozambique: An observational study. PLoS Med. 2017 Jun;14(6):e1002318. [PMC free article] [PubMed]
56.Reekie J, Roberts C, Preen D, Hocking JS, Donovan B, Ward J, Mak DB, Liu B., Chlamydia and Reproductive Health Outcome Investigators. Chlamydia trachomatis and the risk of spontaneous preterm birth, babies who are born small for gestational age, and stillbirth: a population-based cohort study. Lancet Infect Dis. 2018 Apr;18(4):452-460. [PubMed]
57.Britton HL, Britton JR. Efficacy of early newborn discharge in a middle-class population. Am J Dis Child. 1984 Nov;138(11):1041-6. [PubMed]
58.Silver RM, Parker CB, Reddy UM, Goldenberg R, Coustan D, Dudley DJ, Saade GR, Stoll B, Koch MA, Conway D, Bukowski R, Hogue CJ, Pinar H, Moore J, Willinger M, Branch DW. Antiphospholipid antibodies in stillbirth. Obstet Gynecol. 2013 Sep;122(3):641-57. [PMC free article] [PubMed]
59.Cervera R, Conti F, Doria A, Iaccarino L, Valesini G. Does seronegative antiphospholipid syndrome really exist? Autoimmun Rev. 2012 Jun;11(8):581-4. [PubMed]
60.Andreoli L, Chighizola CB, Banzato A, Pons-Estel GJ, Ramire de Jesus G, Erkan D. Estimated frequency of antiphospholipid antibodies in patients with pregnancy morbidity, stroke, myocardial infarction, and deep vein thrombosis: a critical review of the literature. Arthritis Care Res (Hoboken). 2013 Nov;65(11):1869-73. [PubMed]
61.Yelnik CM, Laskin CA, Porter TF, Branch DW, Buyon JP, Guerra MM, Lockshin MD, Petri M, Merrill JT, Sammaritano LR, Kim MY, Salmon JE. Lupus anticoagulant is the main predictor of adverse pregnancy outcomes in aPL-positive patients: validation of PROMISSE study results. Lupus Sci Med. 2016;3(1):e000131. [PMC free article] [PubMed]
62.Ruffatti A, Calligaro A, Hoxha A, Trevisanuto D, Ruffatti AT, Gervasi MT, Cuffaro S, Pengo V, Punzi L. Laboratory and clinical features of pregnant women with antiphospholipid syndrome and neonatal outcome. Arthritis Care Res (Hoboken). 2010 Mar;62(3):302-7. [PubMed]
63.Chighizola CB, Pregnolato F, Andreoli L, Bodio C, Cesana L, Comerio C, Gerosa M, Grossi C, Kumar R, Lazzaroni MG, Mahler M, Mattia E, Nalli C, Norman GL, Raimondo MG, Ruffatti A, Tonello M, Trespidi L, Tincani A, Borghi MO, Meroni PL. Beyond thrombosis: Anti-β2GPI domain 1 antibodies identify late pregnancy morbidity in anti-phospholipid syndrome. J Autoimmun. 2018 Jun;90:76-83. [PubMed]
64.Pengo V, Tripodi A, Reber G, Rand JH, Ortel TL, Galli M, De Groot PG., Subcommittee on Lupus Anticoagulant/Antiphospholipid Antibody of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. Update of the guidelines for lupus anticoagulant detection. Subcommittee on Lupus Anticoagulant/Antiphospholipid Antibody of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost. 2009 Oct;7(10):1737-40. [PubMed]
65.Abou-Nassar K, Carrier M, Ramsay T, Rodger MA. The association between antiphospholipid antibodies and placenta mediated complications: a systematic review and meta-analysis. Thromb Res. 2011 Jul;128(1):77-85. [PubMed]
66.Bouvier S, Cochery-Nouvellon E, Lavigne-Lissalde G, Mercier E, Marchetti T, Balducchi JP, Marès P, Gris JC. Comparative incidence of pregnancy outcomes in treated obstetric antiphospholipid syndrome: the NOH-APS observational study. Blood. 2014 Jan 16;123(3):404-13. [PubMed]
67.Fredi M, Andreoli L, Aggogeri E, Bettiga E, Lazzaroni MG, Le Guern V, Lojacono A, Morel N, Piette JC, Zatti S, Costedoat-Chalumeau N, Tincani A. Risk Factors for Adverse Maternal and Fetal Outcomes in Women With Confirmed aPL Positivity: Results From a Multicenter Study of 283 Pregnancies. Front Immunol. 2018;9:864. [PMC free article] [PubMed]
68.Schreiber K, Radin M, Sciascia S. Current insights in obstetric antiphospholipid syndrome. Curr Opin Obstet Gynecol. 2017 Dec;29(6):397-403. [PubMed]
69.Yamada H, Atsumi T, Kobashi G, Ota C, Kato EH, Tsuruga N, Ohta K, Yasuda S, Koike T, Minakami H. Antiphospholipid antibodies increase the risk of pregnancy-induced hypertension and adverse pregnancy outcomes. J Reprod Immunol. 2009 Jan;79(2):188-95. [PubMed]
70.Out HJ, Kooijman CD, Bruinse HW, Derksen RH. Histopathological findings in placentae from patients with intra-uterine fetal death and anti-phospholipid antibodies. Eur J Obstet Gynecol Reprod Biol. 1991 Oct 08;41(3):179-86. [PubMed]
71.Cervera R, Rodríguez-Pintó I, Espinosa G. The diagnosis and clinical management of the catastrophic antiphospholipid syndrome: A comprehensive review. J Autoimmun. 2018 Aug;92:1-11. [PubMed]
72.Yurdakök M. Fetal and neonatal effects of anticoagulants used in pregnancy: a review. Turk J Pediatr. 2012 May-Jun;54(3):207-15. [PubMed]
73.Wu O, Robertson L, Twaddle S, Lowe GD, Clark P, Greaves M, Walker ID, Langhorne P, Brenkel I, Regan L, Greer I. Screening for thrombophilia in high-risk situations: systematic review and cost-effectiveness analysis. The Thrombosis: Risk and Economic Assessment of Thrombophilia Screening (TREATS) study. Health Technol Assess. 2006 Apr;10(11):1-110. [PubMed]
74.Lin J, Gu W, Hou Y. Diagnosis and prognosis of early-onset intrahepatic cholestasis of pregnancy: a prospective study. J Matern Fetal Neonatal Med. 2019 Mar;32(6):997-1003. [PubMed]
75.Allen AM, Kim WR, Larson JJ, Rosedahl JK, Yawn BP, McKeon K, Hay JE. The Epidemiology of Liver Diseases Unique to Pregnancy in a US Community: A Population-Based Study. Clin Gastroenterol Hepatol. 2016 Feb;14(2):287-94.e1-2. [PMC free article] [PubMed]
76.Al Inizi S, Gupta R, Gale A. Fetal tachyarrhythmia with atrial flutter in obstetric cholestasis. Int J Gynaecol Obstet. 2006 Apr;93(1):53-4. [PubMed
]77.Reid R, Ivey KJ, Rencoret RH, Storey B. Fetal complications of obstetric cholestasis. Br Med J. 1976 Apr 10;1(6014):870-2. [PMC free article] [PubMed]
78.Geenes V, Chappell LC, Seed PT, Steer PJ, Knight M, Williamson C. Association of severe intrahepatic cholestasis of pregnancy with adverse pregnancy outcomes: a prospective population-based case-control study. Hepatology. 2014 Apr;59(4):1482-91. [PMC free article] [PubMed]
79.Ovadia C, Seed PT, Sklavounos A, Geenes V, Di Ilio C, Chambers J, Kohari K, Bacq Y, Bozkurt N, Brun-Furrer R, Bull L, Estiú MC, Grymowicz M, Gunaydin B, Hague WM, Haslinger C, Hu Y, Kawakita T, Kebapcilar AG, Kebapcilar L, Kondrackienė J, Koster MPH, Kowalska-Kańka A, Kupčinskas L, Lee RH, Locatelli A, Macias RIR, Marschall HU, Oudijk MA, Raz Y, Rimon E, Shan D, Shao Y, Tribe R, Tripodi V, Yayla Abide C, Yenidede I, Thornton JG, Chappell LC, Williamson C. Association of adverse perinatal outcomes of intrahepatic cholestasis of pregnancy with biochemical markers: results of aggregate and individual patient data meta-analyses. Lancet. 2019 Mar 02;393(10174):899-909. [PMC free article] [PubMed]
80.Heikkinen J, Mäentausta O, Ylöstalo P, Jänne O. Changes in serum bile acid concentrations during normal pregnancy, in patients with intrahepatic cholestasis of pregnancy and in pregnant women with itching. Br J Obstet Gynaecol. 1981 Mar;88(3):240-5. [PubMed]
81.MacDorman MF, Reddy UM, Silver RM. Trends in Stillbirth by Gestational Age in the United States, 2006-2012. Obstet Gynecol. 2015 Dec;126(6):1146-50. [PMC free article] [PubMed]
82.Qureshi ZU, Millum J, Blencowe H, Kelley M, Fottrell E, Lawn JE, Costello A, Colbourn T. Stillbirth should be given greater priority on the global health agenda. BMJ. 2015 Sep 23;351:h4620. [PMC free article] [PubMed]
83.MacDorman MF, Gregory EC. Fetal and Perinatal Mortality: United States, 2013. Natl Vital Stat Rep. 2015 Jul 23;64(8):1-24. [PubMed]
84.Bukowski R, Hansen NI, Pinar H, Willinger M, Reddy UM, Parker CB, Silver RM, Dudley DJ, Stoll BJ, Saade GR, Koch MA, Hogue C, Varner MW, Conway DL, Coustan D, Goldenberg RL., Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD) Stillbirth Collaborative Research Network (SCRN). Altered fetal growth, placental abnormalities, and stillbirth. PLoS One. 2017;12(8):e0182874. [PMC free article] [PubMed]
85.McPherson E, Nestoridi E, Heinke D, Roberts DJ, Fretts R, Yazdy MM, Lin AE. Alternatives to Autopsy for Fetal and Early Neonatal (Perinatal) Deaths: Insights from the Wisconsin Stillbirth Service Program. Birth Defects Res. 2017 Nov 01;109(18):1430-1441. [PubMed]
86.Cannie M, Votino C, Moerman P, Vanheste R, Segers V, Van Berkel K, Hanssens M, Kang X, Cos T, Kir M, Balepa L, Divano L, Foulon W, De Mey J, Jani J. Acceptance, reliability and confidence of diagnosis of fetal and neonatal virtuopsy compared with conventional autopsy: a prospective study. Ultrasound Obstet Gynecol. 2012 Jun;39(6):659-65. [PubMed]
87.Pinar H, Koch MA, Hawkins H, Heim-Hall J, Shehata B, Thorsten VR, Carpenter M, Lowichik A, Reddy UM. The Stillbirth Collaborative Research Network (SCRN) placental and umbilical cord examination protocol. Am J Perinatol. 2011 Dec;28(10):781-92. [PMC free article] [PubMed]
88.Michalski ST, Porter J, Pauli RM. Costs and consequences of comprehensive stillbirth assessment. Am J Obstet Gynecol. 2002 May;186(5):1027-34. [PubMed]
89.Swenson E, Schema L, McPherson E. Radiographic evaluation of stillbirth: what does it contribute? Am J Med Genet A. 2014 Sep;164A(9):2270-5. [PubMed]
90.Whitby EH, Offiah AC, Cohen MC. Initial experiences of a minimally invasive autopsy service. A report of the techniques and observations in the first 11 cases. Pediatr Dev Pathol. 2015 Jan-Feb;18(1):24-9. [PubMed]
91.Shruthi M, Gupta N, Jana M, Mridha AR, Kumar A, Agarwal R, Sharma R, Deka D, Gupta AK, Kabra M. Conventional vs virtual autopsy with postmortem MRI in phenotypic characterization of stillbirths and fetal malformations. Ultrasound Obstet Gynecol. 2018 Feb;51(2):236-245. [PubMed]
92.Cartlidge PH, Stewart JH. Effect of changing the stillbirth definition on evaluation of perinatal mortality rates. Lancet. 1995 Aug 19;346(8973):486-8. [PubMed]
93.Faye-Petersen OM, Guinn DA, Wenstrom KD. Value of perinatal autopsy. Obstet Gynecol. 1999 Dec;94(6):915-20. [PubMed]
94.Stormdal Bring H, Hulthén Varli IA, Kublickas M, Papadogiannakis N, Pettersson K. Causes of stillbirth at different gestational ages in singleton pregnancies. Acta Obstet Gynecol Scand. 2014 Jan;93(1):86-92. [PubMed]
95.Korteweg FJ, Erwich JJ, Timmer A, van der Meer J, Ravisé JM, Veeger NJ, Holm JP. Evaluation of 1025 fetal deaths: proposed diagnostic workup. Am J Obstet Gynecol. 2012 Jan;206(1):53.e1-53.e12. [PubMed]
96.Reddy UM, Page GP, Saade GR, Silver RM, Thorsten VR, Parker CB, Pinar H, Willinger M, Stoll BJ, Heim-Hall J, Varner MW, Goldenberg RL, Bukowski R, Wapner RJ, Drews-Botsch CD, O’Brien BM, Dudley DJ, Levy B., NICHD Stillbirth Collaborative Research Network. Karyotype versus microarray testing for genetic abnormalities after stillbirth. N Engl J Med. 2012 Dec 06;367(23):2185-93. [PMC free article] [PubMed]
97.Crotti L, Tester DJ, White WM, Bartos DC, Insolia R, Besana A, Kunic JD, Will ML, Velasco EJ, Bair JJ, Ghidoni A, Cetin I, Van Dyke DL, Wick MJ, Brost B, Delisle BP, Facchinetti F, George AL, Schwartz PJ, Ackerman MJ. Long QT syndrome-associated mutations in intrauterine fetal death. JAMA. 2013 Apr 10;309(14):1473-82. [PMC free article] [PubMed]
98.Biankin SA, Arbuckle SM, Graf NS. Autopsy findings in a series of five cases of fetomaternal haemorrhages. Pathology. 2003 Aug;35(4):319-24. [PubMed]
99.Davis BH. Enumeration of Fetal Red Blood Cells, Hemoglobin-Specific RBC Cells, and F Reticulocytes in Human Blood. Curr Protoc Cytom. 2019 Sep;90(1):e56. [PubMed]
100.Goldenberg RL, McClure EM, Saleem S, Reddy UM. Infection-related stillbirths. Lancet. 2010 Apr 24;375(9724):1482-90. [PMC free article] [PubMed]
101.Erez O, Mastrolia SA, Thachil J. Disseminated intravascular coagulation in pregnancy: insights in pathophysiology, diagnosis and management. Am J Obstet Gynecol. 2015 Oct;213(4):452-63. [PubMed]
102.Peters MD, Lisy K, Riitano D, Jordan Z, Aromataris E. Caring for families experiencing stillbirth: Evidence-based guidance for maternity care providers. Women Birth. 2015 Dec;28(4):272-8. [PubMed]
103.Atienza-Carrasco J, Linares-Abad M, Padilla-Ruiz M, Morales-Gil IM. Breaking bad news to antenatal patients with strategies to lessen the pain: a qualitative study. Reprod Health. 2018 Jan 23;15(1):11. [PMC free article] [PubMed]
104.Maslow AD, Breen TW, Sarna MC, Soni AK, Watkins J, Oriol NE. Prevalence of coagulation abnormalities associated with intrauterine fetal death. Can J Anaesth. 1996 Dec;43(12):1237-43. [PubMed]
105.Kerns JL, Ti A, Aksel S, Lederle L, Sokoloff A, Steinauer J. Disseminated Intravascular Coagulation and Hemorrhage After Dilation and Evacuation Abortion for Fetal Death. Obstet Gynecol. 2019 Oct;134(4):708-713. [PubMed]
106.Edlow AG, Hou MY, Maurer R, Benson C, Delli-Bovi L, Goldberg AB. Uterine evacuation for second-trimester fetal death and maternal morbidity. Obstet Gynecol. 2011 Feb;117(2 Pt 1):307-16. [PubMed]
107.Ngai SW, Tang OS, Ho PC. Prostaglandins for induction of second-trimester termination and intrauterine death. Best Pract Res Clin Obstet Gynaecol. 2003 Oct;17(5):765-75. [PubMed]
108.Gómez Ponce de León R, Wing DA. Misoprostol for termination of pregnancy with intrauterine fetal demise in the second and third trimester of pregnancy – a systematic review. Contraception. 2009 Apr;79(4):259-71. [PubMed]
109.Bugalho A, Bique C, Machungo F, Faáundes A. Induction of labor with intravaginal misoprostol in intrauterine fetal death. Am J Obstet Gynecol. 1994 Aug;171(2):538-41. [PubMed]
110.Amin KV, Chauhan AR, Goel A. Current Practices of Cervical Ripening and Induction of Labour in Intrauterine Foetal Demise: An Observational Study. J Obstet Gynaecol India. 2019 Feb;69(1):37-42. [PMC free article] [PubMed]
111.Lydon-Rochelle M, Holt VL, Easterling TR, Martin DP. Risk of uterine rupture during labor among women with a prior cesarean delivery. N Engl J Med. 2001 Jul 05;345(1):3-8. [PubMed]
112.Perritt JB, Burke A, Edelman AB. Interruption of nonviable pregnancies of 24-28 weeks’ gestation using medical methods: release date June 2013 SFP guideline #20133. Contraception. 2013 Sep;88(3):341-9. [PubMed]
113.Goyal V. Uterine rupture in second-trimester misoprostol-induced abortion after cesarean delivery: a systematic review. Obstet Gynecol. 2009 May;113(5):1117-23. [PubMed]
114.Gómez Ponce de León R, Wing D, Fiala C. Misoprostol for intrauterine fetal death. Int J Gynaecol Obstet. 2007 Dec;99 Suppl 2:S190-3. [PubMed]
115.Chauhan AR, Singhal TT, Raut VS. Is internal podalic version a lost art? Optimum mode of delivery in transverse lie. J Postgrad Med. 2001 Jan-Mar;47(1):15-8. [PubMed]
116.Siassakos D, Jackson S, Gleeson K, Chebsey C, Ellis A, Storey C., INSIGHT Study Group. All bereaved parents are entitled to good care after stillbirth: a mixed-methods multicentre study (INSIGHT). BJOG. 2018 Jan;125(2):160-170. [PMC free article] [PubMed]
117.Säflund K, Sjögren B, Wredling R. The role of caregivers after a stillbirth: views and experiences of parents. Birth. 2004 Jun;31(2):132-7. [PubMed]
118.Hughes P, Turton P, Hopper E, Evans CD. Assessment of guidelines for good practice in psychosocial care of mothers after stillbirth: a cohort study. Lancet. 2002 Jul 13;360(9327):114-8. [PubMed]
119.Miller LH, Lindley LC, Mixer SJ, Fornehed ML, Niederhauser VP. Developing a perinatal memory-making program at a children’s hospital. MCN Am J Matern Child Nurs. 2014 Mar-Apr;39(2):102-6. [PubMed]
120.Feroz A, Ibrahim MN, McClure EM, Ali AS, Tikmani SS, Reza S, Abbasi Z, Raza J, Yasmin H, Bano K, Zafar A, Siddiqi S, Goldenberg RL, Saleem S. Perceptions of parents and religious leaders regarding minimal invasive tissue sampling to identify the cause of death in stillbirths and neonates: results from a qualitative study. Reprod Health. 2019 May 10;16(1):53. [PMC free article] [PubMed]
121.Wilson RE. Parents’ support of their other children after a miscarriage or perinatal death. Early Hum Dev. 2001 Mar;61(2):55-65. [PubMed]
122.Heazell AE, Leisher S, Cregan M, Flenady V, Frøen JF, Gravensteen IK, de Groot-Noordenbos M, de Groot P, Hale S, Jennings B, McNamara K, Millard C, Erwich JJ. Sharing experiences to improve bereavement support and clinical care after stillbirth: report of the 7th annual meeting of the International Stillbirth Alliance. Acta Obstet Gynecol Scand. 2013 Mar;92(3):352-61. [PubMed]
123.Kangatharan C, Labram S, Bhattacharya S. Interpregnancy interval following miscarriage and adverse pregnancy outcomes: systematic review and meta-analysis. Hum Reprod Update. 2017 Mar 01;23(2):221-231. [PubMed]
124.Regan AK, Gissler M, Magnus MC, Håberg SE, Ball S, Malacova E, Nassar N, Leonard H, Pereira G. Association between interpregnancy interval and adverse birth outcomes in women with a previous stillbirth: an international cohort study. Lancet. 2019 Apr 13;393(10180):1527-1535. [PubMed]
125.Säflund K, Sjögren B, Wredling R. Physicians’ attitudes and advice concerning pregnancy subsequent to the birth of a stillborn child. J Psychosom Obstet Gynaecol. 2002 Jun;23(2):109-15. [PubMed]
126.Wall-Wieler E, Carmichael SL, Gibbs RS, Lyell DJ, Girsen AI, El-Sayed YY, Butwick AJ. Severe Maternal Morbidity Among Stillbirth and Live Birth Deliveries in California. Obstet Gynecol. 2019 Aug;134(2):310-317. [PMC free article] [PubMed]
127.Bateman BT, Berman MF, Riley LE, Leffert LR. The epidemiology of postpartum hemorrhage in a large, nationwide sample of deliveries. Anesth Analg. 2010 May 01;110(5):1368-73. [PubMed]
128.Steegers EA, von Dadelszen P, Duvekot JJ, Pijnenborg R. Pre-eclampsia. Lancet. 2010 Aug 21;376(9741):631-44. [PubMed]
129.Patterson JA, Roberts CL, Bowen JR, Irving DO, Isbister JP, Morris JM, Ford JB. Blood transfusion during pregnancy, birth, and the postnatal period. Obstet Gynecol. 2014 Jan;123(1):126-33. [PubMed]
130.Ray JG, Park AL, Dzakpasu S, Dayan N, Deb-Rinker P, Luo W, Joseph KS. Prevalence of Severe Maternal Morbidity and Factors Associated With Maternal Mortality in Ontario, Canada. JAMA Netw Open. 2018 Nov 02;1(7):e184571. [PMC free article] [PubMed]
131.Rabinerson D, Kedar L, Borovich A. [BLUNT AND PENETRATING ABDOMINAL INJURIES DURING PREGNANCY]. Harefuah. 2019 Dec;158(12):817-821. [PubMed]
132.Nkusu Nunyalulendho D, Einterz EM. Advanced abdominal pregnancy: case report and review of 163 cases reported since 1946. Rural Remote Health. 2008 Oct-Dec;8(4):1087. [PubMed]
133.Matovelo D, Ng’walida N. Hemoperitoneum in advanced abdominal pregnancy with a live baby: a case report. BMC Res Notes. 2014 Feb 25;7:106. [PMC free article] [PubMed]
134.Tolefac PN, Abanda MH, Minkande JZ, Priso EB. The challenge in the diagnosis and management of an advanced abdominal pregnancy in a resource-low setting: a case report. J Med Case Rep. 2017 Jul 24;11(1):199. [PMC free article] [PubMed]
135.Dahab AA, Aburass R, Shawkat W, Babgi R, Essa O, Mujallid RH. Full-term extrauterine abdominal pregnancy: a case report. J Med Case Rep. 2011 Oct 31;5:531. [PMC free article] [PubMed]
136.Rabinerson D, Berezowsky A, Gabbay-Benziv R. [ADVANCED ABDOMINAL PREGNANCY]. Harefuah. 2017 Feb;156(2):114-117. [PubMed]
137.Habeš D, Střecha M, Kalousek I, Kestřánek J. Uterine rupture during pregnancy. Ceska Gynekol. 2019 Summer;84(5):345-350. [PubMed]
138.De Franciscis P, Schiattarella A, Labriola D, Tammaro C, Messalli EM, La Mantia E, Montella M, Torella M. A partial molar pregnancy associated with a fetus with intrauterine growth restriction delivered at 31 weeks: a case report. J Med Case Rep. 2019 Jul 04;13(1):204. [PMC free article] [PubMed]
139.Kawasaki K, Kondoh E, Minamiguchi S, Matsuda F, Higasa K, Fujita K, Mogami H, Chigusa Y, Konishi I. Live-born diploid fetus complicated with partial molar pregnancy presenting with pre-eclampsia, maternal anemia, and seemingly huge placenta: A rare case of confined placental mosaicism and literature review. J Obstet Gynaecol Res. 2016 Aug;42(8):911-7. [PubMed]
140.Ciobanou A, Jabak S, De Castro H, Frei L, Akolekar R, Nicolaides KH. Biomarkers of impaired placentation at 35-37 weeks’ gestation in the prediction of adverse perinatal outcome. Ultrasound Obstet Gynecol. 2019 Jul;54(1):79-86. [PubMed]
141.Valiño N, Giunta G, Gallo DM, Akolekar R, Nicolaides KH. Biophysical and biochemical markers at 30-34 weeks’ gestation in the prediction of adverse perinatal outcome. Ultrasound Obstet Gynecol. 2016 Feb;47(2):194-202. [PubMed]
142.Sherrell H, Dunn L, Clifton V, Kumar S. Systematic review of maternal Placental Growth Factor levels in late pregnancy as a predictor of adverse intrapartum and perinatal outcomes. Eur J Obstet Gynecol Reprod Biol. 2018 Jun;225:26-34. [PubMed]
143.Gaccioli F, Sovio U, Cook E, Hund M, Charnock-Jones DS, Smith GCS. Screening for fetal growth restriction using ultrasound and the sFLT1/PlGF ratio in nulliparous women: a prospective cohort study. Lancet Child Adolesc Health. 2018 Aug;2(8):569-581. [PMC free article] [PubMed]
144.Heazell AE, Hayes DJ, Whitworth M, Takwoingi Y, Bayliss SE, Davenport C. Biochemical tests of placental function versus ultrasound assessment of fetal size for stillbirth and small-for-gestational-age infants. Cochrane Database Syst Rev. 2019 May 14;5:CD012245. [PMC free article] [PubMed]
145.Middleton P, Shepherd E, Crowther CA. Induction of labour for improving birth outcomes for women at or beyond term. Cochrane Database Syst Rev. 2018 May 09;5:CD004945. [PMC free article] [PubMed]
146.Lilford RJ, Chard T. Problems and pitfalls of risk assessment in antenatal care. Br J Obstet Gynaecol. 1983 Jun;90(6):507-10. [PubMed]
147.Grant A, Elbourne D, Valentin L, Alexander S. Routine formal fetal movement counting and risk of antepartum late death in normally formed singletons. Lancet. 1989 Aug 12;2(8659):345-9. [PubMed]
148.De Muylder X. The kick chart in high-risk pregnancies: a two-year experience in Zimbabwe. Int J Gynaecol Obstet. 1988 Dec;27(3):353-7. [PubMed]
149.Norman JE, Heazell AEP, Rodriguez A, Weir CJ, Stock SJE, Calderwood CJ, Cunningham Burley S, Frøen JF, Geary M, Breathnach F, Hunter A, McAuliffe FM, Higgins MF, Murdoch E, Ross-Davie M, Scott J, Whyte S., AFFIRM investigators. Awareness of fetal movements and care package to reduce fetal mortality (AFFIRM): a stepped wedge, cluster-randomised trial. Lancet. 2018 Nov 03;392(10158):1629-1638. [PMC free article] [PubMed]
150.Bricker L, Medley N, Pratt JJ. Routine ultrasound in late pregnancy (after 24 weeks’ gestation). Cochrane Database Syst Rev. 2015 Jun 29;(6):CD001451. [PMC free article] [PubMed]
151.Divon MY, Ferber A. Doppler evaluation of the fetus. Clin Obstet Gynecol. 2002 Dec;45(4):1015-25. [PubMed]
152.Pattinson RC, Cuthbert A, Vannevel V. Pelvimetry for fetal cephalic presentations at or near term for deciding on mode of delivery. Cochrane Database Syst Rev. 2017 Mar 30;3:CD000161. [PMC free article] [PubMed]
153.Dudley DJ. Diabetic-associated stillbirth: incidence, pathophysiology, and prevention. Clin Perinatol. 2007 Dec;34(4):611-26, vii. [PubMed]
154.Boehm FH, Gabbe SG. Putting it all together. Clin Obstet Gynecol. 2002 Dec;45(4):1063-8. [PubMed]
155.Nageotte MP, Towers CV, Asrat T, Freeman RK. Perinatal outcome with the modified biophysical profile. Am J Obstet Gynecol. 1994 Jun;170(6):1672-6. [PubMed]
156.Signore C, Freeman RK, Spong CY. Antenatal testing-a reevaluation: executive summary of a Eunice Kennedy Shriver National Institute of Child Health and Human Development workshop. Obstet Gynecol. 2009 Mar;113(3):687-701. [PMC free article] [PubMed]
157.Lalor J, Devane D. Using the biophysical profile to assess fetal wellbeing. Pract Midwife. 2010 Jun;13(6):16-7. [PubMed]
158.Tan KH, Smyth R. Fetal vibroacoustic stimulation for facilitation of tests of fetal wellbeing. Cochrane Database Syst Rev. 2001;(1):CD002963. [PubMed]
159.Papadopoulos VG, Decavalas GO, Kondakis XG, Beratis NG. Vibroacoustic stimulation in abnormal biophysical profile: verification of facilitation of fetal well-being. Early Hum Dev. 2007 Mar;83(3):191-7. [PubMed]
160.Erez O, Shoham-Vardi I, Sheiner E, Dukler D, Bashiri A, Mazor M. Hydramnios and small for gestational age are independent risk factors for neonatal mortality and maternal morbidity. Arch Gynecol Obstet. 2005 Apr;271(4):296-301. [PubMed]
161.Nabhan AF, Abdelmoula YA. Amniotic fluid index versus single deepest vertical pocket as a screening test for preventing adverse pregnancy outcome. Cochrane Database Syst Rev. 2008 Jul 16;(3):CD006593. [PMC free article] [PubMed]
162.Alfirevic Z, Luckas M, Walkinshaw SA, McFarlane M, Curran R. A randomised comparison between amniotic fluid index and maximum pool depth in the monitoring of post-term pregnancy. Br J Obstet Gynaecol. 1997 Feb;104(2):207-11. [PubMed
]163.Crowther CA. Hospitalisation and bed rest for multiple pregnancy. Cochrane Database Syst Rev. 2001;(1):CD000110. [PubMed]
164.Menzies J, Magee LA, Li J, MacNab YC, Yin R, Stuart H, Baraty B, Lam E, Hamilton T, Lee SK, von Dadelszen P., Preeclampsia Integrated Estimate of RiSk (PIERS) Study Group. Instituting surveillance guidelines and adverse outcomes in preeclampsia. Obstet Gynecol. 2007 Jul;110(1):121-7. [PubMed]
165.Devane D, Lalor JG, Daly S, McGuire W, Smith V. Cardiotocography versus intermittent auscultation of fetal heart on admission to labour ward for assessment of fetal wellbeing. Cochrane Database Syst Rev. 2012 Feb 15;(2):CD005122. [PubMed]
166.East CE, Chan FY, Colditz PB, Begg LM. Fetal pulse oximetry for fetal assessment in labour. Cochrane Database Syst Rev. 2007 Apr 18;(2):CD004075. [PubMed]
167.Neilson JP. Fetal electrocardiogram (ECG) for fetal monitoring during labour. Cochrane Database Syst Rev. 2015 Dec 21;(12):CD000116. [PMC free article] [PubMed]
168.Bhattacharya S, Prescott GJ, Black M, Shetty A. Recurrence risk of stillbirth in a second pregnancy. BJOG. 2010 Sep;117(10):1243-7. [PubMed]
169.Gordon A, Raynes-Greenow C, McGeechan K, Morris J, Jeffery H. Stillbirth risk in a second pregnancy. Obstet Gynecol. 2012 Mar;119(3):509-17. [PubMed]
170.Janssen HJ, Cuisinier MC, Hoogduin KA, de Graauw KP. Controlled prospective study on the mental health of women following pregnancy loss. Am J Psychiatry. 1996 Feb;153(2):226-30. [PubMed]
171.Temple R, Aldridge V, Greenwood R, Heyburn P, Sampson M, Stanley K. Association between outcome of pregnancy and glycaemic control in early pregnancy in type 1 diabetes: population based study. BMJ. 2002 Nov 30;325(7375):1275-6. [PMC free article] [PubMed]
172.Tennant PW, Glinianaia SV, Bilous RW, Rankin J, Bell R. Pre-existing diabetes, maternal glycated haemoglobin, and the risks of fetal and infant death: a population-based study. Diabetologia. 2014 Feb;57(2):285-94. [PubMed]
173.Hostage JC, Brock J, Craig W, Sepulveda D. Integrating Screening, Brief Intervention and Referral to Treatment (SBIRT) for Substance Use into Prenatal Care. Matern Child Health J. 2020 Apr;24(4):412-418. [PubMed]
174.Mohan M, Antonios A, Konje J, Lindow S, Ahmed Syed M, Akobeng A. Stillbirth and associated perinatal outcomes in obstetric cholestasis: a systematic review and meta-analysis of observational studies. Eur J Obstet Gynecol Reprod Biol X. 2019 Jul;3:100026. [PMC free article] [PubMed]175.Stratulat P, Curteanu A, Caraus T, Petrov V, Gardosi J. The experience of the implementation of perinatal audit in Moldova. BJOG. 2014 Sep;121 Suppl 4:167-71. [PubMed]
176.Pattinson R, Kerber K, Waiswa P, Day LT, Mussell F, Asiruddin SK, Blencowe H, Lawn JE. Perinatal mortality audit: counting, accountability, and overcoming challenges in scaling up in low- and middle-income countries. Int J Gynaecol Obstet. 2009 Oct;107 Suppl 1:S113-21, S121-2. [PubMed]
177.de Bernis L, Kinney MV, Stones W, Ten Hoope-Bender P, Vivio D, Leisher SH, Bhutta ZA, Gülmezoglu M, Mathai M, Belizán JM, Franco L, McDougall L, Zeitlin J, Malata A, Dickson KE, Lawn JE., Lancet Ending Preventable Stillbirths Series study group. Lancet Ending Preventable Stillbirths Series Advisory Group. Stillbirths: ending preventable deaths by 2030. Lancet. 2016 Feb 13;387(10019):703-16. [PubMed]













 Abdurrahman Onen
Abdurrahman Onen  Figura 1 . Sistema de classificação de hidronefrose SFU.
Figura 1 . Sistema de classificação de hidronefrose SFU.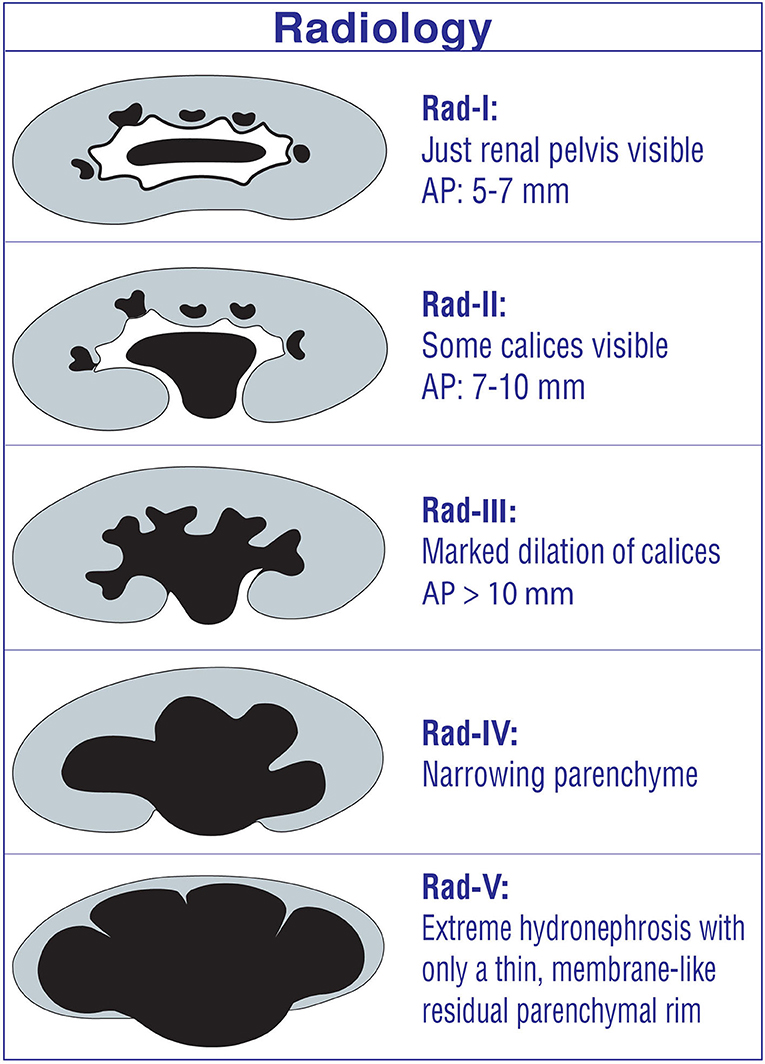
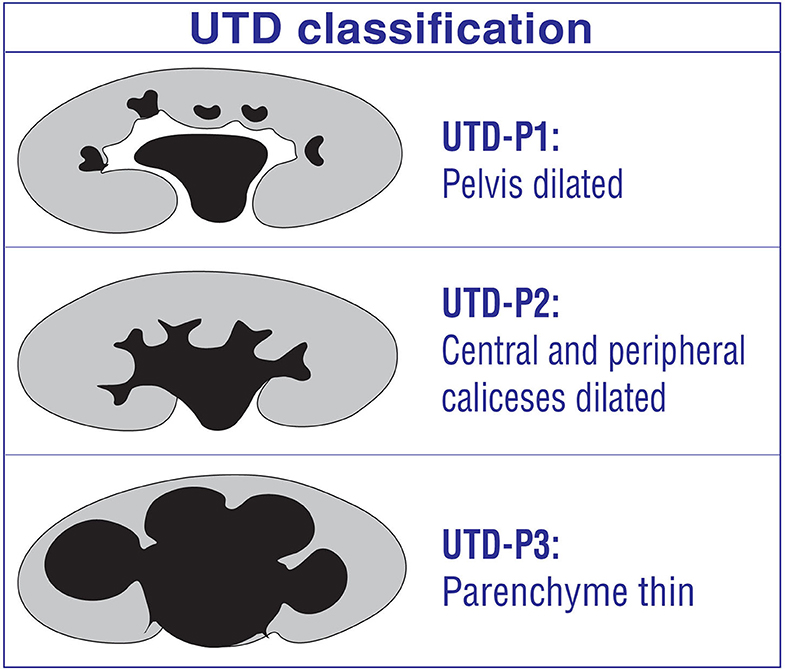
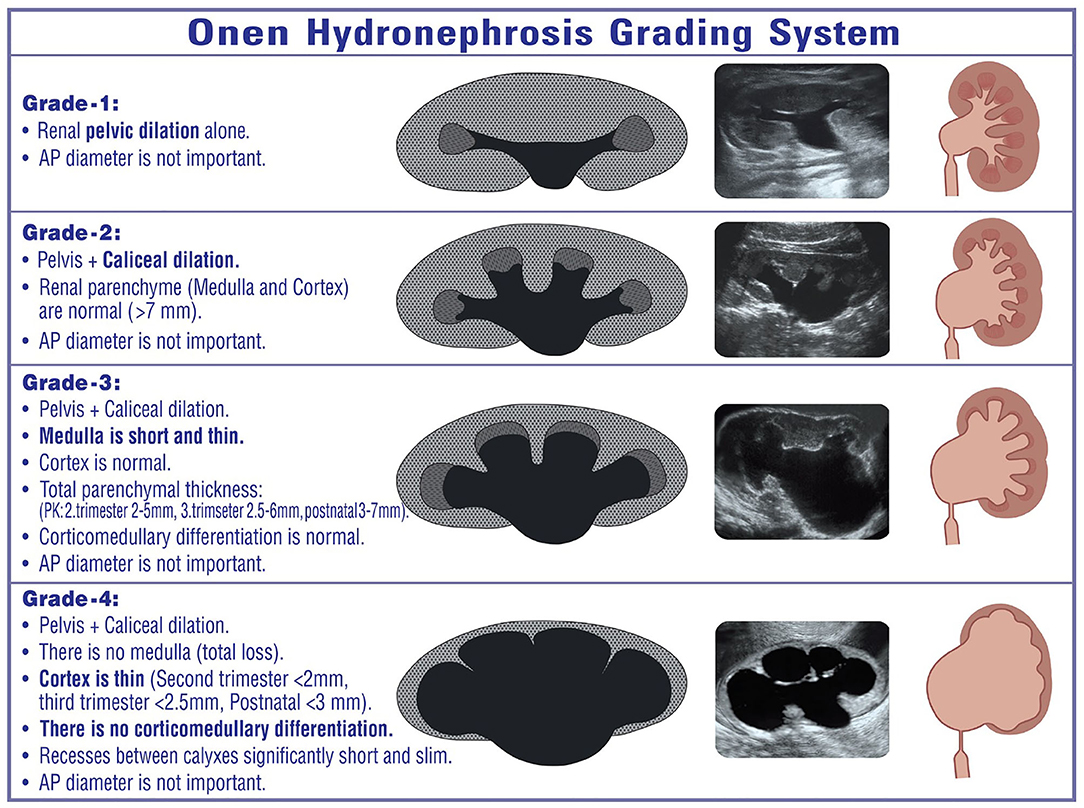
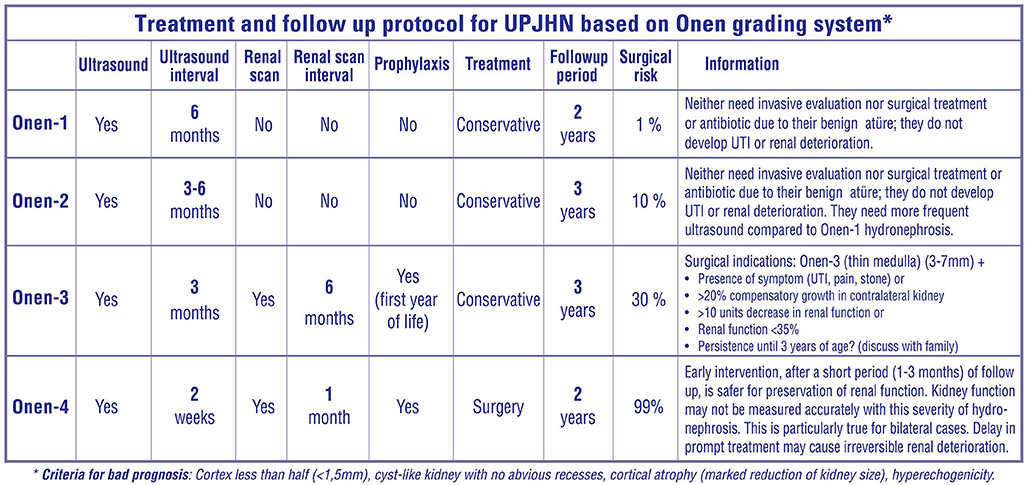
 Figura 6 . Comparação de sistemas de graduação de hidronefrose.
Figura 6 . Comparação de sistemas de graduação de hidronefrose.